

Механизм и технология гальванического цинкования. Структура и свойства гальванических покрытий.
Содержание:
1. Что такое цинк и каковы его коррозионные характеристики?
2. Электролиты для цинкования.
1. Что такое цинк и каковы его коррозионные характеристики?
- Цинк представляет собой металл светло-серого цвета с голубоватым оттенком.
- Температура плавления составляет 419,5° С, а плотность 7,133 г/см3. В холодном состоянии цинк хрупок, а при температуре 100-150°С весьма пластичен, хорошо гнется и легко прокатывается в листы и фольгу толщиной до сотых долей миллиметра. При температуре >250° С он вновь становится хрупким и легко превращается в порошок.
- Металл можно паять используя активные флюсы, например, ZnCl2.
- Обладает средней твердостью, которая в значительной мере зависит от способа его получения и чистоты. Твердость цинковых покрытий колеблется от 0,4 до 2,0 ГПа.
- Большое влияние на скорость коррозии цинка оказывает величина рН среды. В интервале рН 7-12 цинк практически не растворяется. Скорость коррозии возрастает при отклонении от указанных значений.



Оцинковка является наиболее распространенным способом покрытия стали и чугуна для защиты от атмосферной коррозии. На эти цели расходуется приблизительно 40 % мировой добычи цинка.
Цинкование — это нанесение тонкого слоя цинка на изделие для придания ему требуемых характеристик (защита от коррозии, цвет, блеск, износостойкость и т.п.).
Широкое распространение цинкования объясняется анодным характером защиты. Потенциал цинка равен - 0,763 В, что отрицательнее потенциала черных металлов: стали, железа, чугуна, поэтому покрытие защищает их от коррозии электрохимическим путем. Защитные свойства покрытий сохраняются даже при малой толщине слоя, а также при наличии пор и обнаженных участков. Известны многочисленные примеры протекторного действия покрытия на оголенные участки стали, например, обрезанные края оцинкованного железа, поперечное сечение проволоки, непокрытая резьба гайки, если она навинчена на оцинкованный винт, и т. п.
|
Обозначение |
Ц.хр - радужное (желтое) Ц.хр.бцв - бесцветное (белое) Ц.хр.хаки - хаки (оливковое) Ц.хр.ч - черное Ц.фос - с фосфатированием Zink coating - англ. обозначение |
|
Толщина |
6-50мкм (возможна и большая толщина) |
|
Микротвердость |
490-1180 МПа |
|
Удельное электрическое сопротивление при 18оC |
5,75×10-8 Ом⋅м |
|
Допустимая рабочая температура |
300°C |
Анодный характер защиты стали покрытием в некоторых случаях может замениться катодным, и тогда коррозия происходит весьма интенсивно. Подобное влияние наблюдается под воздействием горячей воды при температуре выше 70°С (котельные установки, автоклавы). В сухом воздухе при комнатной температуре цинк почти не окисляется. Начиная с температуры 225°С, скорость окисления на воздухе быстро возрастает.
Во влажном воздухе и в морской воде, особенно в присутствии СО2 и SO2, цинк быстро разрушается даже при комнатной температуре, покрываясь поверхностной пленкой основных гидрокарбонатов. По мере накопления на поверхности продуктов коррозии и частичного заполнения ими пор скорость коррозии цинка уменьшается, и пленка служит дополнительной защитой. В горячей воде может начаться язвенная коррозия с образованием белых чашеобразных отложений вокруг газовых пузырей.
Особенно значительна скорость коррозии цинка в атмосфере промышленных городов и в тропиках.
При сильном нагревании на воздухе, особенно при наличии СО2, цинк сгорает, образуя оксид цинка. Цинк легко растворяется в растворах сильных кислот с образованием соответствующих солей и водорода.
При взаимодействии с разбавленными кислотами НСl и H2SO4 выделяется водород:
Zn + 2Н+ → Zn2+ + Н2
а с HNO3 - оксиды азота.
Растворы сильных щелочей окисляют цинк с образованием растворимых в воде цинкатов. Химически чистый цинк, в отличие от загрязненного примесями других металлов, растворяется в кислотах и щелочах медленно. Это происходит вследствие того, что водород, который при этой реакции должен выделяться, имеет высокое перенапряжение.
Цинк обладает низкой химической стойкостью при воздействии летучих продуктов, выделяющихся при старении таких органических материалов, какими являются синтетические смолы, олифы, хлорированные углеводороды. Покрытия цинком легко разрушаются, если они находятся в контакте или в закрытом объеме со свежеокрашенными или промасленными деталями.
Таким образом, защитное действие покрытия определяется в первую очередь его толщиной, зависящей от условий эксплуатации изделий. Далее речь пойдет о гальваническом цинковании.
|
Характеристика условий эксплуатации |
Толщина, мкм |
Обозначение покрытия по ГОСТ 9.306-85 |
|
Эксплуатация в отапливаемых и вентилируемых помещения температура воздуха 25±10°С, и влажности 65±15% |
6-9 |
Ц.6 |
|
Эксплуатация под навесом и в неотапливаемых помещениях; отсутствие воздействия атмосферных осадков; атмосфера загрязнена небольшим количеством промышленных газов; температура воздуха от -60 до +60°С, относительная влажность 95±3% |
15-18 |
Ц.15.хр |
|
Эксплуатация на открытом воздухе; воздействие атмосферных осадков, туманов; атмосфера загрязнена промышленными газами, пылью; температура среды от -60 до +80°С, относительная влажность 95±3% |
24-30 |
Ц.24.хр |
|
Эксплуатация в особых условиях |
36-42 |
Ц.36.хр |
|
Примечание: хр - хроматная обработка покрытия |
||
Защитные свойства могут быть значительно увеличены различными способами, наиболее распространенными из которых являются:
- образование на поверхности цинка хроматных пленок посредством химической обработки оцинкованных деталей в растворах, содержащих хромовую кислоту или ее соли; подобная операция называется пассивированием или хроматированием;
- образование на покрытии фосфатных пленок в результате обработки деталей в растворах, содержащих соли фосфорной кислоты;
- нанесение дополнительных лакокрасочных покрытий, при этом лучшие результаты получаются, если лакокрасочной операции предшествует фосфатирование.
2. Электролиты для нанесения покрытия.
Качество покрытий во многом определяется характером применяемого электролита.

Электролиты для цинкования можно разделить на две основные группы:
- Простые кислые (сульфатные, хлоридные, борфтористоводородные), в которых цинк находится в виде гидротированных ионов;
- Сложные комплексные, в которых цинк присутствует в виде комплексных ионов, заряженных отрицательно или положительно. Из комплексных электролитов известны цианидные, цинкатные, аммиакатные, пирофосфатные и другие.
От природы и состава электролитов зависят качество осадков на катоде и скорость процесса осаждения. Так как качество осадков и скорость процесса в значительной степени определяются характером и степенью изменения катодных потенциалов, то для сравнительной оценки электролитов цинкования (как и других видов покрытий металлами) лучше всего исходить из относительного расположения поляризационных кривых. Чем выше катодная поляризация, тем более мелкозернистые и равномерные по толщине осадки на катоде.
Сравнение поляризационных кривых показывает (рисунок 1), что наименьшая поляризация характерна для процесса цинкования в сульфатном электролите, наибольшая - в цианидном и близком к нему цинкатном.
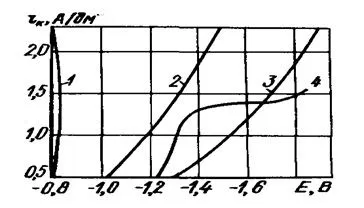
Рисунок 1 — График катодной поляризации цинковых электролитов: 1 - сульфатный; 2 - аммонийный; 3 - цианистый; 4 - цинкатный.
В первом случае повышение плотности тока почти не сопровождается изменением выхода металла по току, в отличие от щелочных растворов, в особенности цианидных, где выход по току с ростом плотности тока уменьшается. Поэтому кислые электролиты пригодны для цинкования деталей простой конфигурации, ленты, проволоки. Они допускают применение больших плотностей тока, чем цианидные и, следовательно, отличаются большей скоростью наращивания покрытий. Осаждение цинка из сложных электролитов протекает при высокой рассеивающей способности, поэтому эти электролиты дают не только мелкозернистые, но и равномерные покрытия на деталях, как простой, так и сложной формы.
Перенапряжение водорода на цинке достигает значительной величины: при катодной плотности тока 1 А/дм2 оно равно 0,75 В, а при 3 А/дм2 — приближается к 1 В. В связи с этим катодный выход по току цинка в простых электролитах достигает 96-98 %; следовательно, на катоде происходит преимущественный разряд ионов цинка.
При нанесении покрытий в сложных электролитах происходит совместное выделение цинка и водорода. Скорость выделения водорода увеличивается по мере возрастания плотности тока, так как при этом возрастает потенциал выделения цинка. Выделение водорода приводит к значительному наводороживанию изделий, что ухудшает их механические свойства - уменьшается пластичность и увеличивается склонность стали к хрупкому разрушению. Поэтому в электролитах с низким выходом по току не допускается нанесение цинка на детали, изготовленные с пределом прочности 1400 МПа и более.


2.1 Простой кислый электролит.
Эти электролиты нашли наиболее широкое применение в промышленности. Использование их позволяет осаждать цинк с высокой скоростью. Кислые электролиты стабильны в работе, высокопроизводительны, сравнительно дешевы.
Удовлетворительные по внешнему виду осадки можно получать из простых кислых электролитов, содержащих только соль цинка и небольшое количество серной кислоты. Однако на практике для улучшения качества покрытия к раствору соли обычно добавляют поверхностно-активные вещества, а также соли щелочных металлов и вещества, сообщающие буферные свойства электролиту.
Основная реакция на катоде:
Zn2+ + 2e = Zn
Концентрация цинка выбирается в зависимости от требуемой скорости процесса. Чем больше концентрация в растворе, тем выше допустимая плотность тока, но тем менее равномерны по толщине осадки цинка. Для цинкования деталей могут применяться растворы с концентрацией соли цинка от 20-30 до 700-800 г/л. Высококонцентрированные электролиты применяют на непрерывных агрегатах цинкования полосы, проволоки и труб.


Практически применяют электролиты с рН = 4-5, так как при большой кислотности раствора выход по току на катоде сильно снижается вследствие выделения водорода, а выход по току на аноде возрастает за счет химического растворения цинка. Нейтральные цинковые растворы также не пригодны для цинкования, поскольку в результате выделения водорода и подщелачивания среды у катода образуются гидроокиси, загрязняющие осадок и ухудшающие качество покрытия.
Для поддержания рН около 4,5 в электролит вводят буферные добавки - уксусную, чаще борную кислоту (20-30 г/л). Вместо уксусной кислоты целесообразно вводить ацетат натрия, который после прибавления серной кислоты дает эквивалентное количество слабодиссоциированной уксусной кислоты. Хорошими буферными свойствами обладает электролит, содержащий около 30 г/л сульфата алюминия или алюмокалиевых квасцов. В присутствии солей алюминия при рН=4,5 повышается катодная поляризация (рисунок 2) и осадки получаются светлыми, полублестящими мелкозернистой структуры.
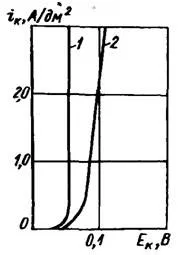
Рисунок 2 — влияние сульфата алюминия на поляризуемость: 1 — без добавок; 2 — при наличие Al2(SO4)3.
Буферные свойства сульфата алюминия основаны на том, что при рН=4-4,5 он подвергается гидролизу с образованием H2SO4
Al2(SO4)3 + 6Н2O ↔ 2Аl(ОН)3 + 3H2SO4
К сульфатному электролиту добавляют иногда соли других, не выделяющихся на катоде, металлов, например, сульфаты или хлориды натрия и аммония (до 2 г-экв/л и более), главным образом для увеличения электропроводности растворов. При добавлении сульфатов повышается катодная поляризация, что способствует улучшению распределения металла по поверхности катода.
В случаях, когда к внешнему виду, коррозионной стойкости, макро- и микрораспределению цинкового покрытия предъявляются повышенные требования, в кислые электролиты вводят многокомпонентные органические блескообразователи, содержащие добавки для повышения рассеивающей, кроющей и выравнивающей способности, скорости осаждения покрытия и его блеска. Существуют блескообразователи, которые позволяют получать на деталях средней конфигурации из кислых электролитов достаточно равномерные по толщине и выравнивающие микропрофиль поверхности блестящие покрытия при высоких плотностях тока (до 10 А/дм2). В качестве добавок к кислым электролитам широко применяют декстрин, глюкозу, желатин, столярный клей, фенолы, глицерин и другие.
Какие примеси вредны в кислом электролите?
Вредными примесями в кислых электролитах являются соли более электроположительных, чем цинк, металлов, например, соли меди (0,01 г/л), мышьяка (0,001-0,005 г/л), сурьмы (0,001-0,01 г/л), свинца, все соли азотной кислоты и некоторые органические вещества (скипидар, ацетон, клей) и др. В присутствии малых количеств (доли грамма на литр) электроположительных металлов в кислом цинковом электролите на катоде образуются губчатые осадки, вследствие выделения этих металлов на предельном диффузионном токе.
- Свинец, присутствующий в сульфатном электролите цинкования, в отсутствие хлоридов и декстрина не влияет на качество осадков цинка вследствие малой растворимости сульфата свинца, которая в нейтральной водной среде составляет примерно 0,01 г/л (считая на металл).
- В сульфатном электролите, содержащем добавки декстрина, и в электролитах, содержащих хлор-ион, осадок цинка на катоде темнеет уже при концентрации свинца около 0,05 г/л, а при концентрации 0,3 г/л и выше на поверхности катода образуется губчатый осадок черного цвета.
- Олово при концентрации до 0,3 г/л не оказывает влияния на внешний вид покрытия. С увеличением содержания олова до 1 г/л при плотности тока около 100 А/м2 катодные осадки становятся темными, рыхлыми, что объясняется восстановлением ионов олова на предельном диффузионном токе. Железо оказывает большое влияние на качество осадков цинка в электролитах с органическими добавками.
- Для удаления примесей электроположительных металлов предварительно подкисленный электролит прорабатывают постоянным током при низкой плотности тока.
- Соли железа удаляют в виде гидроокиси Fe(OH)3 после нейтрализации раствора бикарбонатом натрия и добавления перекиси водорода или персульфата щелочных металлов при нагревании до 70-100°С. После отстаивания осадка Fe(OH)3 раствор декантируют или фильтруют.
- В присутствии нитратов на катоде образуются губчатые осадки, включающие гидроокись цинка, образование которой объясняется восстановлением NO3- до аммиака и гидроксиламина и подщелачиванием в связи с этим прикатодного слоя. Губка устраняется только при сильном подкислении электролита, которое при небольших плотностях тока вызывает значительное снижение выхода по току.
Для удаления вредных органических примесей применяют в зависимости от природы этих примесей проработку электролита постоянным током со свинцовыми анодами (при отсутствии в растворе хлор-иона) при ia = 500-1000 А/м2, обработку перекисью марганца, активированным углем и т.п.
Температура кислых электролитов поддерживается обычно в пределах 18-25 °С. При электролизе с высокими плотностями тока (>5·102 А/м2) в электролитах, не содержащих органические добавки (например, при цинковании проволоки, ленты, листов), температуру повышают до 50 °С.
Плотности тока на катоде в неперемешиваемых электролитах составляют не выше 200-300 А/м2. При перемешивании электролита сжатым воздухом допустимый верхний предел плотности тока может быть значительно увеличен в зависимости от состава и температуры электролита, вида покрываемых изделий (детали, проволока, лента, листы).
Значительно увеличиваются допустимые плотности тока (до 200-500 А/м2) и улучшается декоративный вид осадков цинка при электролизе с применением ультразвука. Катодные выходы по току колеблются в пределах 95-100% в зависимости от рН, t и iк.
Аноды для цинкования в кислых электролитах изготавливают, как правило, из чистого электролитического цинка (99,8-99,9% Zn), который может содержать не более 0,03% свинца, 0,02% кадмия, 0,002% меди, 0,04% железа и 0,001% олова.
Во всех кислых электролитах аноды растворяются с высоким выходом по току, который при рН-1-2 составляет более 100% вследствие коррозии.
Во избежание загрязнения электролита анодным шламом аноды следует заключать в чехлы из фильтровальной ткани или хлорина. Рекомендуется применять цинк, содержащий 0,05-0,2% магния и 0,25-1% кальция. Аноды из такого цинка в меньшей степени образуют шлам и растворяются с малым выходом по току, благодаря чему электролит более устойчивый.
В последнее время получили распространение литые аноды разных конфигураций: в виде шариков, цилиндриков и др., которые загружают в сетчатые корзины из титана. Применение анодов такой формы позволяет полнее использовать металл и сократить его расход по сравнению с пластинчатыми анодами.
Примерные составы и режим работы кислых электролитов приведены в таблице 2.
|
Компоненты электролитов |
Состав электролитов |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
ZnSO4·7H2O |
215 |
200-250 |
140 |
70-100 |
─ |
450-700 |
─ |
|
ZnCl2 |
─ |
─ |
─ |
─ |
─ |
─ |
200-250 |
|
Zn(BF4)2 |
─ |
─ |
─ |
─ |
250-300 |
─ |
─ |
|
Al2(SO4)3·18H2O |
30 |
25-30 |
─ |
─ |
─ |
25-30 |
─ |
|
Na2SO4·10H2O |
50-100 |
─ |
70 |
─ |
─ |
─ |
─ |
|
NH4Cl |
─ |
─ |
─ |
200-250 |
─ |
─ |
250-300 |
|
NH4BF4 |
─ |
─ |
─ |
─ |
25-30 |
─ |
─ |
|
CH3COONH4 |
─ |
─ |
─ |
30-40 |
─ |
─ |
─ |
|
NaCl |
─ |
─ |
25 |
─ |
─ |
─ |
─ |
|
H3BO3 |
─ |
25-30 |
─ |
─ |
10-15 |
─ |
─ |
|
Декстрин |
10 |
8-10 |
─ |
─ |
─ |
─ |
─ |
|
Диспергатор НФ |
─ |
─ |
─ |
50-100мл/л |
─ |
─ |
─ |
|
ДЦУ |
─ |
0,5-1 |
2 |
─ |
─ |
─ |
─ |
|
У-2 |
─ |
1-1,5 |
─ |
─ |
─ |
─ |
─ |
|
ОП-10 |
─ |
─ |
─ |
─ |
8-10 |
─ |
─ |
|
Тиокарбомид |
─ |
─ |
─ |
─ |
2-3 |
─ |
─ |
|
pH |
3,8-4,5 |
4-4,2 |
2 |
3,5-5 |
3-4,5 |
3,5-4,5 |
3,8-5 |
|
t, oC |
18-25 |
15-30 |
20 |
18-25 |
20 |
40-50 |
18-65 |
|
iк, А/дм2·10-2 |
0,5-2 |
1-3 |
2 |
1-3 |
до 4-5 |
10-300 |
10-100 |
При катодной плотности тока более 200 А/м2 все электролиты нужно перемешивать сжатым воздухом, очищенным от пыли и масла, и фильтровать непрерывно или периодически. Электролит 2 рекомендуют для получения блестящих цинковых покрытий на изделиях простой конфигурации при соотношении анодной и катодной поверхности Sa : SK = 2 : 1.
Электролит 3 дает блестящие осадки при концентрации ДЦУ не менее 4 г/л. Электролит 6 рекомендуют применять при интенсивном перемешивании сжатым воздухом и непрерывном перетекании (с фильтрованием) для цинкования листов, движущихся (непрерывно) проволоки и ленты.
Чем меньше диаметр проволоки и ширина ленты, тем больше допустимая плотность тока. Электролит 7 применяют для тех же целей, что и электролит 6, но при меньших допустимых плотностях тока.
Таким образом, не смотря на все положительные стороны кислых электролитов, а, именно, стабильность в работе, высокую производительность, относительную дешевизну, малое наводораживание стальных деталей, они имеют и ряд недостатков, основным из которых является низкая рассеивающая способность. Однако за последние годы в связи с повышением требований к экологической безопасности технологических процессов вообще, и гальванических в частности, были преложены электролиты на основе хлористого цинка с блескообразующими добавками как более перспективные для получения блестящих цинковых покрытий.
2.2 Слабокислые электролиты на основе хлорида цинка.
В особую группу выделяют слабокислые электролиты цинкования на основе хлорида цинка. Эти электролиты характеризуются высокой электропроводностью (в два раза выше сульфатных) и интенсивностью процесса. Водород выделяется в незначительных количествах, т.е. малая наводороживаемость деталей, а, значит, не возникает водородная хрупкость. Однако наличие хлоридов в электролите вызывает интенсивную коррозию оборудования, поэтому ванны, бортовые отсосы, фильтры, насосы, запорную арматуру и другое вспомогательное оборудование, соприкасающееся с электролитом, изготавливают из коррозионно - стойких материалов. Для этих целей широко применяются полипропилен, поливинилхлорид, фторопласт и ряд других конструкционных пластмасс. Кроме того, остатки хлоридов в порах покрытия могут способствовать усилению коррозии покрытия, поэтому промывка деталей должна быть организована очень хорошо.
Покрытия, получаемые из слабокислых электролитов, имеют маленькие внутренние напряжения, что уменьшает склонность покрытия к разрушению.
В связи с указанными особенностями слабокислые электролиты рекомендуют применять для цинкования мелких деталей в барабанах и в конвейерных установках. Некоторые составы слабокислых электролитов приведены в таблице 3.
|
Компоненты
|
Электролит 1 |
Электролит 2 |
Электролит 3 |
|
ZnCl2 |
60-120 |
20-70 |
100-120 |
|
КСl(NaCl) |
180-230 |
200-250 |
200-230 |
|
H3BO3 |
15-30 |
15-30 |
- |
|
NH4Cl |
- |
- |
20-25 |
|
Лимеда НЦ-10 |
30-70 |
20-70 |
- |
|
Лимеда НЦ-20 |
2,5-5,0 |
2,5-10 |
- |
|
iк, А/дм2 |
0,5-5,0 |
0,5-1,5 |
50 |
|
t, °С |
15-30 |
15-30 |
40-60 |
|
pH |
4,5-6 |
4,5-5,8 |
3-4 |
В практике цинкования листовой стали и проволоки применяют электролит 3. Однако большим минусом этого электролита является высокая концентрация ионов аммония, что значительно затрудняет очистку сточных вод гальванических производств.
Электролит 2 предназначен для нанесения цинка во вращательных установках. Его рекомендуют периодически (не реже одного раза в сутки) фильтровать.
Для цинкования деталей с использованием электролита 1 необходимо перемешивание сжатым воздухом и постоянная фильтрация для удаления механических загрязнений. Последнее вызвано тем, что на местах осаждения загрязнений на поверхности происходит возрастание локальной плотности тока, сопровождающееся интенсивным ростом в этом месте дендритов. Поэтому чем выше плотность тока, тем более тщательной должна быть очистка электролита.
В настоящее время разработан новый электролит слабокислого цинкования, в который вводят в качестве буферной добавки ацетат натрия вместо токсичного вещества борной кислоты. Данный электролит обладает всеми достоинствами электролитов, указанных в таблице 3, однако более экологичен.

2.3 Комплексные цианистые электролиты.
В цианистых электролитах цинк находится в виде комплексных анионов Zn(CN)42-и Zn(OH)42-. Образуются они по реакциям:
Zn(OH)2 + 4NaCN = Na2[Zn(CN)4] + 2NaOH
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Осаждение же цинка происходит по схеме:
Na2[Zn(CN)4] ↔ 2Na+ + Zn(CN)42-
Zn(CN)42- + 2е → Zn + 4OH-
а при избытке щелочи:
Na2[Zn(OH)4] ↔ 2Na+ + [Zn(OH)4]2-
[Zn(OH)4]2- + 2е → Zn + 4OH-
Благодаря высокой рассеивающей способности и стабильности в работе катодный выход по току в цианистых электролитах достигает 50-80%. Широкое применение цианистым электролитам нашли в промышленности для цинкования изделий сложной формы.
Количество цианистой соли цинка и цинката натрия зависит от количества цианистого натрия и едкого натра в электролите. Осаждение происходит из двух соединениях одновременно.
Избыточное количество цианидов необходимо для увеличения рассеивающей способности, в то же время увеличение содержания цианидов влечет за собой снижение катодного выхода по току.
Едкий натр вводится в электролит для расширения интервала рабочих плотностей тока, повышение электропроводности, а также для предотвращения образования синильной кислоты.
Глицерин вводится для улучшения структуры покрытия и получения полублестящих осадков. Назначение сульфида натрия состоит в осаждении в виде нерастворимых сульфидов катионов тяжелых металлов, случайно попадающих в электролит.
Состав цианистых ванн приведен в таблице 4.
|
Компоненты и режим работы |
Номер электролита |
||
|
1 |
2 |
3 |
|
|
Компоненты г/л |
|
||
|
Окись цинка |
20-45 |
8-10 |
20-30 |
|
Цианистый калий |
- |
- |
60-80 |
|
Цианистый натрий |
50-120 |
18-20 |
- |
|
Едкий натр |
50-100 |
60-80 |
- |
|
Едкое кали |
- |
- |
75-110 |
|
Сернистый калий |
0,5-5,0 |
- |
3-7 |
|
Глицерин |
3-5 |
- |
3-5 |
|
Метатитанат калия |
- |
- |
0,7-1,0 |
|
Режим работы |
|
||
|
Температура электролита, ºС |
15-20 |
15-25 |
15-25 |
|
Плотность тока, А/дм2: |
|
||
|
Без перемешивания |
1,0-3,0 |
0,5-2,5 |
1,0-3,0 |
|
При перемешивании |
До 8,0 |
- |
До 4 |
|
Выход по току, % |
60-80 |
70-85 |
70-90 |
Электролит 1 предназначен для покрытия деталей на подвесах. Электролит 2 обладает рядом преимуществ. Он отличается хорошей кроющей способностью, меньшей чувствительностью к примесям тяжелых металлов, требует меньших затрат на обработку сточных вод.
2.4 Аммиакатные (хлораммонийные) электролиты.
С целью замены токсичных цианистых электролитов и снижения затрат на обезвреживание сточных вод, содержащих цианиды, в промышленности получили большое распространение аммиакатные электролиты, в которых цинк находится в виде комплексного катиона типа Zn(NH3)n(H2O)m2+, где
n=2 в кислой среде, n=4 в щелочной среде.
Аммиакатные соединения цинка получаются при взаимодействии окиси цинка с аммонийными солями по реакции:
ZnO + nNH4Cl = Zn(NH3)nCl2 + H2O
Осаждение ведется по реакции:
[Zn(NH3)n]2+ + 2е + nH2O = Zn + nNH4+ + nOH-
Хорошая рассеивающая способность электролита, близкая к рассеивающей способности цианистых электролитов обуславливается также их высокой электропроводностью. Удельная электропроводность аммиакатных электролитов на 30-40% выше, чем у цианистых. Повышенная электропроводность электролита играет важную роль при покрытии деталей в колоколах или барабанах, так как достигается возможность ведения процесса при напряжении 5 В. Аммиакатные электролиты практически безвредны для рабочих, обслуживающих ванны, стабильны в работе и легко корректируются.
Аммиакатные электролиты имеют ряд технических преимуществ:
• С их помощью легче покрываются чугуны;
• Тонкостенные и термообработанные детали не подвергаются наводораживанию вследствие высокого выхода по току.
В состав электролитов вводят буферные соединения для стабилизации величины рН в катодной зоне. В качестве буферных соединений используют борную кислоту или уксуснокислые соли. Величина рН электролитов оказывает большое влияние на рассеивающую способность и структуру покрытий. По мере увеличения рН рассеивающая способность улучшается. В отличие от цианистых, аммиакатные электролиты менее чувствительные к попаданию в них органических примесей. Так как они слабощелочные или почти нейтральные, то не разрушают изоляционные материалы, наносимые на подвески или на поверхность покрываемых деталей.
|
Компоненты и режим работы |
Номер электролита |
|||
|
1 |
2 |
3 |
4 |
|
|
Компоненты, г/л |
|
|||
|
Окись цинка |
10-20 |
40-60 |
35-40 |
- |
|
Сернокислый цинк |
- |
- |
- |
80-100 |
|
Хлористый аммоний |
200-300 |
240-250 |
200-220 |
200-250 |
|
Борная кислота |
25-30 |
- |
- |
- |
|
Уротропин |
- |
40-60 |
20-25 |
- |
|
Аммиак водный 25%-ный |
- |
100-120 |
- |
- |
|
Мездровый клей |
1-2 |
2-4 |
- |
- |
|
Препарат ОС-20 |
- |
- |
4-5 |
- |
|
Диспергатор НФ, мл/л |
- |
- |
6-8 |
17-35 |
|
Режим работы |
|
|||
|
рН |
5,9-6,5 |
8,0-8,4 |
7,8-8,2 |
3,5-4,5 |
|
Температура, ºС |
15-25 |
15-25 |
15-25 |
18-25 |
|
Плотность тока, А/дм2 |
0,5-1,0 |
1,0-2,0 |
2,0-3,0 |
3,0-5,0 |
|
Выход по току, % |
95-98 |
96-98 |
94-98 |
- |
Электролит 1 дешевле и проще по составу, рекомендуется для покрытия деталей с простым профилем и деталей в колокольных и барабанных ваннах.
Электролит 2 обладает наибольшей рассеивающей способностью и рекомендуется для покрытия сложногопрофиля.
Электролит 4 применяется только для покрытия мелких деталей в барабанах и колоколах, так как в стационарных ваннах происходит интенсивное растворение анодов и обильное шламообразование.
Основным недостатком аммиакатных электролитов является неизбежное наличие солей аммония в сточных водах, что является недопустимым по современным требованиям санитарии.
2.5 Щелочные цинкатные электролиты.
Цинкатные электролиты, как и аммиакатные, применяются для замены цианистых электролитов. Высокая рассеивающая способность цинкатных электролитов обусловливается хорошей электропроводностью электролита. Существенное влияние на повышение рассеивающей способности оказывает снижение выхода по току с увеличением плотности тока.
Кинетика катодного процесса при оцинковке из цинкатного щелочного электролита гораздо сложнее, чем это обычно представляется в учебных материалах и технической литературе. Обычно речь идет о реакциях:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в момент приготовления электролита)
Na2[Zn(OH)4] ↔ 2Na+ + [Zn(OH)4]2-
[Zn(OH)4]2- + 2е → Zn + 4OH-
Однако, в объеме раствора могут присутствовать и другие комплексы цинка, а разряд на катоде может идти даже из электронейтральных частиц.
Важно заметить, что состав и строение комплексов Zn(II) в объеме электролита отличается от таковых на поверхности катода в процессе реакции. Так, в объеме при высокой концентрации щелочи преобладает комплекс [Zn(ОН)4]2- (тетрагидроксоцинкат натрия). В низкощелочной среде кроме этого комплекса обнаруживаются частицы [Zn(ОН)]+, [Zn(ОН)2] и [Zn(ОН)3]-. В них, соответственно, содержится менее 4х групп OH-. Такие данные были получены методами измерения равновесного потенциала, колебательной спектроскопии, ЯМР-спектроскопии и методом растворимости. Результаты не вызывают сомнений.
Изначально считалось, что на амальгамированном цинковом электроде в цинкатном растворе цинк восстанавливается по реакции:
Zn(ОН)2 + 2е → Zn + 2ОН-
На это указывали многие исследователи. В таком механизме два электрона переходят на электронейтральную частицу. Однако, с современных позиций теории полярных растворителей это маловероятно, гораздо вероятнее перенос заряда по одному электрону. В этом разрезе существует несколько многостадийных теорий, основанных на результатах хронопотенциометрии, снятии потенциодинамических кривых и температурно-кинетическом методе.
Первый механизм разряда цинка из тетрагидроксоцинката натрия заключается в последовательно протекании химической, электрохимической, химической и снова электрохимической стадий:
[Zn(ОН)4]2-∙4Н2О ↔ [Zn(ОН)2∙2Н2О] + 2OH- + 2Н2О
[Zn(ОН)2∙2Н2О] + е ↔ [Zn(ОН)2]-∙2Н2О
[Zn(ОН)2]- ∙2Н2О ↔ [ZnОН] + ОН- + 2Н2O
[ZnОН] + e → Zn + ОН-
Иначе этот механизм именуется СЕСЕ.
При разряде комплекса с тремя группами OH- последовательность видоизменяется:
[Zn(ОН)3]- ↔ [Zn(ОН)2] + ОН-
[Zn(ОН)2] + е ↔ [ZnОН] + ОН-
[ZnОН] + е ↔ Zn + ОН-
И в том, и в другом случае разряд идет из электронейтральной частицы гидроксида цинка [Zn(ОН)2].
Бокрис доработал механизм разряда тетрагидроксоцинката натрия, предположив, что первый электрон пойдет на [Zn(ОН)3]-, а не на [Zn(ОН)2∙2Н2О]. При этом стадия разряда нейтральной [Zn(ОН)2] отсутствует:
[Zn(ОН)4]2- ↔ [Zn(ОН)3]- + ОН-
[Zn(ОН)3]- + е → [Zn(ОН)2]- + ОН-
[Zn(ОН)2]- ↔ [ZnОН] + ОН-
[ZnОН] + е ↔ Zn + ОН-
Стадия присоединения электрона к [Zn(ОН)3]- здесь лимитирующая.
Еще один механизм разряда тетрагидроксоцинката натрия заключается в трех стадиях:
[Zn(ОН)4]2- ↔ [Zn(ОН)2] + 2OН-
[Zn(ОН)2] + е → [Zn(ОН)] + ОН-
[ZnОН] + е ↔Zn + ОН-
В конечном счете, во всех экспериментальных моделях происходит понижение координационного числа центрального атома цинка по ОН-группам, а финальный разряд цинка идет из нейтральной частицы [ZnОН], где цинк имеет валентность (I).
Составы цинкатных электролитов приведены в таблице 6.
|
Компоненты и режим работы |
Номер электролита |
||
|
1 |
2 |
3 |
|
|
Компоненты, г/л (мл/л) |
|
||
|
Окись цинка, г/л |
10-17 |
12-15 |
12-15 |
|
Едкий натр, г/л |
90-120 |
100-120 |
80-100 |
|
Блескообразователь 1, мл/л |
9-11 |
- |
- |
|
Блескообразователь 2, мл/л |
9-11 |
- |
- |
|
ПЭПА, г/л |
- |
2-4 |
- |
|
Триэтаноламин, мл/л |
- |
- |
20-30 |
|
Тиомочевина, г/л |
- |
0,5 |
- |
|
Полиэпоксиамин, мл/л |
- |
- |
1,5-2,5 |
|
п-Диметиламинобензальдегид, г/л |
- |
- |
0,2-0,3 |
|
Режим работы |
|
||
|
Температура, ºС |
20-30 |
18-25 |
18-25 |
|
Плотность тока, А/дм2 |
|
||
|
Без перемешивания |
1-4 |
1-2 |
1-4 |
|
При перемешивании |
- |
- |
5-6 |
В электролиты обязательно вводят ПАВ, без которых качественный компактный осадок цинка получить невозможно. Эти же ПАВ, сорбируясь на катодной поверхности, снижают перенапряжение водорода и способствуют увеличению его количества, выделяющегося при повышенных плотностях тока.
Электролит 1 и 3 обеспечивает получение блестящих покрытий цинком. Электролит 2 позволяет получать светлые полублестящие осадки цинка.
2.6 Пирофосфатные электролиты.
Для замены токсичных цианистых электролитов рекомендованы также пирофосфатные электролиты, в которых цинк находится в виде пирофосфатного комплекса аниона [Zn(P2O7)2]6-.
Пирофосфатные электролиты сравнительно безвредные, устойчивы в работе и характеризуются высокой рассеивающей способностью. Однако, вследствие плохой растворимости пирофосфатов цинка, особенно натриевых солей, процесс ведется с обязательным подогревом электролита при относительно низких значениях плотности тока. Цинковые аноды также плохо растворяются в пирофосфатном электролите из-за образования трудно растворимых пленок на поверхности. Помимо пирофосфатов в состав электролитов вводят фосфаты с целью придания электролиту буферных свойств. С целью придания блеска покрытию в электролит вводят добавки органические: сахарин, ванилин, фурфурол. Катодный выход по току 65-90%, причем резкое снижение происходит при увеличении плотности тока до 2,5 А/дм2.
Составы пирофосфатных ванн цинкования приведены в таблице 7.
|
Компоненты и режим работы |
Номер электролита |
|
|
1 |
2 |
|
|
Компоненты, г/л |
|
|
|
Сульфат цинка |
50-90 |
60-70 |
|
Пирофосфат калия |
250-350 |
300-330 |
|
Сульфат аммония |
15-20 |
- |
|
Двухзамещенный фосфат аммония |
- |
45-55 |
|
Хлористый аммоний |
20-50 |
- |
|
Декстрин |
1-3 |
- |
|
Мездровый клей |
3-5 |
- |
|
Сульфаниловая кислота |
- |
0,1-0,5 |
|
Режим работы |
|
|
|
рН |
7,5-8,5 |
8,5-9,0 |
|
Плотность тока (А/дм2) при: |
|
|
|
t =18-20ºC |
2,0-3,5 |
1-2 |
|
t = 45-50ºC |
5,0-5,5 |
2-5 |
|
Анодная плотность тока, А/дм2 |
0,7-1,2 |
0,5-1,0 |
|
Выход по току, % |
85-95 |
83-92 |
Электролит 2 — электролит блестящего цинкования, характеризуемый наибольшей способностью и рекомендуемый для покрытия сложно рельефных деталей.
Подробно анодные процессы при цинковании рассмотрены здесь.

Читайте также статьи
Что такое гальваника
Теоретические основы нанесения гальванических и химических покрытий.
Заказать гальваническое цинкование (Ц.хр)
Сделать заказ цинкования с сертификатом качества на заводе
Фосфатирование стали
Механизм и технология химического процесса. Составы растворов.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



