

Фосфатирование стали | Механизм и технология химического процесса | Составы растворов.
Содержание:
1. Общие сведения о фосфатировании металла.
2. Механизм защитного химического фосфатирования стали.
3. В чем отличия механизма аморфного фосфатирования от кристаллического?
4. Состав и структура фосфатных покрытий.
5. Влияние различных факторов на свойства фосфатного покрытия.
6. Основные проблемы процесса и рекомендации по их решению.
7. Оценка качества фосфатной пленки.
8. Влияние на окружающую среду и обращение с отходами фосфатирования.
1. Общие сведения о фосфатировании металла.
1.1 Назначение, обозначение и свойства фосфатных покрытий на стали.
Фосфатирование — химическая обработка изделий, в результате которой на их поверхности образуется солевое (фосфатное) покрытие, придающее необходимые характеристики (высокая адгезия, электроизоляция и т.д.).
Фосфатное покрытие - это пленка нерастворимых в воде двух- и трехзамещенных солей марганца и железа или цинка и железа, нанесенная на металл-основу. Чаще всего производят фосфатирование стали, реже - цинка. Существуют также оксидно-фосфатные покрытия, рассмотрение которых выходит за рамки этой статьи.
История фосфатирования берет свое начало в 1869 году. Тогда раскаленная сталь была впервые погружена в фосфорную кислоту для получения пленки, защищающей ее от коррозии. В 1906 году впервые было проведено фосфатирование партии стали фосфорной кислотой без нагрева металла. Дальнейшие исследования были направлены на поиск различных соединений-фосфатов для обработки стали, а затем на уменьшение времени покрытия за счет введения ускорителей. В 1950-х годах началось промышленное применение фосфатных покрытий для подшипниковых и скользящих поверхностей.
|
Обозначение |
Хим.фос - фосфатирование для дальнейшей покраски Хим.фос.прм - фосфатирование с промасливанием для увеличения коррозионной стойкости Phosphate conversion coating - англ. обозначение |
|
Оптимальный ряд толщин |
Не нормируется (ориентировочно 15-30мкм) |
|
Микротвердость |
Зависит от марки сплава материала-основы |
|
Удельное электрическое сопротивление при 18°C |
Диэлектрик |
|
Допустимая рабочая температура |
300°C
|
Сегодня область применения фосфатных пленок достаточно обширна:
- Наиболее часто фосфатирование металла применяется в автомобильной промышленности. Фосфаты марганца облегчают скольжение поверхностей и уменьшают износ трущихся деталей. Пленка фосфатов может использоваться как самостоятельное антифрикционное покрытие, а также способна удерживать масла и мыла в своей структуре.
- Фосфатное покрытие используется для антикоррозионной защиты. Оно создает барьер, защищающий детали от контакта с окружающей средой. Для улучшения коррозионной защиты производится дополнительная обработка фосфатной пленки маслом, краской и др. В некоторых случаях защитная способность фосфатных покрытий является уникальной. Так, неодимовые магниты типа NdFeB имеют плохую коррозионную стойкость во многих агрессивных среда из-за наличия в их составе 35% неодима. Применение фосфатного покрытия является наилучшим вариантом для защиты этих магнитов.
- Наличие фосфатной пленки также повышает адгезию стали к последующему ЛКП и позволяет производить окраску даже современными методами (порошково-полимерная окраска и др.). Фосфатирование вызывает значительное повышение стойкости к термическому окислению стали при температурах 300-700°С.
- Фосфатное покрытие при определенных условиях является противозадирным, а также облегчает холодную штамповку стали.
- Фосфаты обладают электроизоляционными свойствами. Они применяются для нанесения электроизоляционного слоя на трансформаторные, роторные и статорные пластины. Пробивное напряжение фосфатов достигает 600 В, при пропитке электроизоляционными лаками - до 1000В. Дополнительный плюс - негорючесть покрытия.
- Фосфатные пленки используются в качестве абсорбирующего покрытия при лазерном упрочнении стали, а также в качестве покрытия для терморегулирования компонентов спутников.
Недостатком фосфатных пленок является:
- Низкая стойкость в кислотах и щелочах.
- Сравнительно низкая механическая прочность и неэластичность.
- Более низкая стойкость к атмосферной коррозии, по сравнению с цинком.
В последние 30 лет работы в данной области были направлены на разработку:
- низкотемпературных ванн (для уменьшения энергопотребления);
- растворов с низким содержанием цинка;
- ускоряющих добавок;
- составов с несколькими катионами тяжелых металлов.
1.2 Фосфорная кислота и ее соли.
Фосфатирование невозможно без фосфорной кислоты. Сама по себе фосфорная кислота трехосновна, в ее растворе присутствуют ионы H2PO4-, HPO42-, PO43- и недиссоциированная кислота H3PO4.
В фосфорной кислоте все три атома водорода могут замещаться, образуя три ряда солей - первичных, вторичных и третичных. Растворимыми в воде являются только первичные фосфаты, остальные (для тяжелых металлов) - практически нет.
Первчиные фосфаты склонны к гидролизу, особенно при повышении рН и температуры. Процесс гидролиза сопровождается образованием вторичных и третичных фосфатов, а также свободной фосфорной кислоты. Чем выше температура и ниже концентрация первичных солей, тем активнее идет их гидролиз.
1.3 Составы растворов для фосфатирования металла.
Все фосфатирующие растворы являются разбавленными, что важно для упрощения диссоциации солей. Как правило, они многокомпонентны.
Основа растворов фосфатирования — первичные фосфаты металлов, в основном железа, марганца и цинка.
Если в процессе фосфатирования использовать первичные фосфаты тяжелых металлов, то полученное покрытие будет кристаллическим, а если щелочных или аммония - аморфным. Катион первичного фосфата может совпадать с металлом-основой, а может отличаться от него.
Содержание свободной фосфорной кислоты в растворе - важнейший параметр процесса. Он определяет направление равновесных реакций. От него, во многом, зависит скорость фосфатирования и качество покрытия. Другим важным параметром является концентрация свободных фосфатов. В зависимости от температуры и концентрации соединений в ванне, необходимо выбрать такое количество свободной кислоты, которое будет поддерживать условия равновесия. Избыток фосфорной кислоты не только замедляет образование покрытия, но и приводит к чрезмерной потере металла.
Существует горячее и холодное фосфатирование. Горячее применяется для получения защитных покрытий. Холодное фосфатирование пригодно для обработки деталей струйным методом, а также для обработки деталей, нагрев которых нежелателен. Покрытия, полученные из холодных растворов, аморфные и пригодны только под окраску.
2. Механизм защитного горячего химического фосфатирования стали.
Сегодня большинство исследователей склоняется к электрохимической природе процесса защитного фосфатирования. Она заключается в том, что поверхность металла при фосфатировании разбивается на микрокатоды, микроаноды и инертные участки. На микроанодах происходит растворение стали. Одним из первых о таком механизме заявил В.Маху, а наибольшее развитие теория получила у Я.М. Колотыркина.
2.1 Исходные условия.
Изначально поверхность стали выглядит так, как показано на рисунке 1.

Рисунок 1 - Микроизображение обезжиренной стали.
Скорость растворения стали с точки зрения электрохимии зависит от:
- потенциалов на границе "сталь / раствор фосфатирования";
- состава и концентрации раствора;
- скорости диффузии компонентов раствора из объема.
Поверхность металла эквипотенциальна, а места протекания сопряженного катодного и анодного процессов постоянно меняются согласно законам статистического распределения. Разброс химического состава поверхности, а также механические дефекты могут приводить к частичной локализации реакций и нарушению распределения.
Как указывалось ранее, основа раствора фосфатирования - первичные фосфаты. Первичные фосфаты подвержены гидролизу.
Для первичных фосфатов железа гидролиз описывается следующими реакциями:
3Fe(H2PO4)2 ↔ 3FeHPO4 + 3H3PO4
3FeHPO4 ↔ Fe3(PO4)2 + H3PO4
а для цинка:
Zn(H2PО4)2 ↔ ZnHPО4 + H3PO4
3ZnHPО4 ↔ Zn3(PО4)2 + H3PО4
Для предотвращения объемного гидролиза однозамещенных фосфатов и выпадения нерастворимого трифосфата раствор должен содержать некоторый избыток фосфорной кислоты, смещающий равновесие влево. В таком состоянии раствор стабилен.
2.2 Начальные процессы при погружении стальной детали в раствор фосфатирования.
При погружении в раствор фосфатирования стальной детали начинается гетерогенная реакция:
Fe + 2H3PO4 → Fe(H2PO4)2 + H2↑
Если точнее, то согласно В.И.Вульфсону формирование фосфатной плѐнки на железе начинается с анодной реакции:
Fe → Fe2+ + 2e (быстрая стадия)
сопряженной с катодным выделением водорода:
2Н+ + 2е → 2Н → Н2↑ (медленная стадия)
Общий процесс замедляется за счет блокировки металлической поверхности газообразным водородом.
По В.Купру при растворении стали может происходить образование переходных комплексов железа с анионами из раствора. Это ускоряет процесс растворения, если анионы слабо связываются с поверхностью детали. В случае же прочной адсорбции анионов наблюдается пассивирование поверхности и процесс растворения стали тормозится. Так, поверхность железа может подвергаться воздействию следующих анионов по реакциям:
Fe + Н2РО4- → FeРО4-+ 2Н+
Fe + НРО42- → FeРО4-+ 2Н+
Продукт-комплексный анион FeРО4- затем участвует в создании на анодных и катодных участках нерастворимых третичных фосфатов.
Другие авторы говорят о присутствии в прианодной зоне не только ионов типа МеРО4-, но и Ме3(НРО4)42-. Первые существуют в окислительной среде, вторые - в растворах без окислителей.
При определенном pH анионы с различной степенью замещения водорода начинают конкурировать между собой в реакциях на поверхности детали:
- Однозарядные анионы, соли которых с железом быстро гидролизуются, активируют травление стали;
- Двух- и трехзарядные анионы, образующие труднорастворимые соли, пассивируют сталь и тормозят процесс.
Из анионов Н2РО4-, НРО42-, РO43- наибольшей степенью адсорбции на стали в области рН=1-5 обладают НРО42-. В этих значениях рН концентрация ионов РO43- минимальна (учитывая константу диссоциации фосфорной кислоты по 3 ступени (1,0·10-13)). При смещении потенциала поверхности в положительную сторону степень ее заполнения двухзарядными анионами возрастает, конкуренция с однозарядными анионами также увеличивается, что приводит к первичной пассивации (см. далее).
Очевидно, что фосфорная кислота в приповерхностном слое будет расходоваться, что приведет к:
- смещению реакций гидролиза вправо;
- локальному увеличению количества ионов железа;
- повышению рН и снижению растворимости третичных фосфатов.
Следствием всего этого является образование зародышей (центров кристаллизации) будущего покрытия на поверхности деталей.
Одновременно с этим, фосфорная кислота, образовавшаяся при гидролизе монофосфата, будет несколько восстанавливать кислотность раствора у поверхности металла, что создаст условия для дальнейшего протекания процесса.
Заметим еще, что нейтрализация фосфорной кислоты протекает не только на поверхности, но и в некоторой степени в объеме раствора.
2.3 Фосфатная пассивация стали.
Процесс пассивации играет очень важную роль в фосфатировании. Типичная хронопотенциограмма пассивации стали при фосфатировании приведена на рисунке 2.
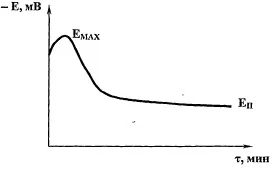
Рисунок 2 — Типичная хронопотенциограмма процесса пассивации стали при фосфатировании: Еmax - потенциал максимума Eп - потенциал полной пассивации.
Монослойная модель пассивации стали рассматривает два механизма:
• Электрохимический:
Fe + НРО42- → FeHPO4 + 2е
• Объемный (в результате адсорбции молекул соли вторичного фосфата, образующейся в приэлектродном слое по реакции):
Fe2+ + НРО42- → FeHPO4
Пассивация стали начинается с образования оксидов (важнейший этап пассивации), на которых в дальнейшем осаждается пористый слой третичных фосфатов железа, уже не так сильно влияющих на пассивное состояние.
Образование пассивирующего слоя происходит при потенциалах первичной пассивации железа: - (100 - 300) мВ (с.в.э.) и сопровождается скачком потенциала в положительную сторону.
2.4 Рост покрытия и окончание процесса.
После этого идет постепенное срастание отдельных кристаллов в сплошную пористую плёнку. По мере роста фосфатного слоя поверхность стали станет изолироваться от воздействия раствора. В этот момент на ней уже четко можно выделить участки с различным электрохимическим поведением:
- поры, трещины, границы зёрен, углубления, выступы и другие дефекты кристаллической решетки металла, являющиеся высокоэнергетическими зонами - аноды (активные центры);
- тонкое покрытие - катоды (большая часть покрытия состоит из них);
- толстое покрытие - инертные участки.
В первую очередь формирование покрытия происходит на микроанодных участках. Однако, А.Ф. Крутиков подтвердил возможность осаждения фосфатов как на микроанодах, так и на микрокатодах. Все дело в том, что после начала процесса микроанодные участки покрываются тонкой аморфной пленкой фосфатов, в результате превращаясь в микрокатодные.
При деполяризации микрокатодных участков гидролизные равновесия смещаются в сторону осаждения нерастворимых вторичных и третичных фосфатов. При этом с увеличением скорости деполяризации, растет скорость гидролиза первичных фосфатов, наступает локальное пересыщение раствора вторичными и третичными фосфатами в микрокатодных зонах, и образуются коллоидные частицы в приповерхностном слое.
Далее коллоидные частицы в результате взаимодействия с катионами раствора приобретают положительный заряд, и затем кристаллизуются на микрокатодных участках поверхности подложки. Образующийся на поверхности тончайший слой коллоидных частиц (оксидов и гидроксидов) переходит, за счет большого количества внутренних центров кристаллизации, в связанный кристаллохимическими связями с металлической основой слой вторичных и третичных фосфатов металла.
Отметим, что по В.Купру из-за высокого значения рН в прианодных зонах значительного пересыщения раствора не происходит, поэтому слой фосфатов формируется тонким и с хорошей адгезией. В прикатодных зонах рН стремительно закисляется и происходит усиленное выделение третичных фосфатов. Последние по В.Купру создают дисперсные системы из заряженных кристаллофосфатов, которые «пристают» к слою зародышей. При этом образуется толстослойная фосфатная пленка.
Со временем скорость фосфатирования сначала уменьшается за счет все большего изолирования поверхности, а затем процесс останавливается. В конце процесса доля свободной поверхности стали (поры) составляет всего 0,1-1% от общей. Окончание процесса становится заметно по прекращению выделения пузырьков водорода. Разница в потенциалах стали до и после фосфатирования может достигать 0,15-0,25 В.
Сформированное фосфатное покрытие можно разделить на:
- Барьерный слой. Первичный, непосредственно прилегающий к металлу. Он гладкий, тонкий и эластичный. Определяет защитную способность и адгезию;
- Наружный слой. Образуется на барьерном, состоит из кристаллов вторичных и третичных фосфатов. Растет в различных направлениях по эпитаксиальным ориентациям, в частности, по поверхностной структуре металлической подложки. Влияет на маслоемкость, электроизоляционные, экструзивные, антифрикционные свойства.
С какой скоростью идет фосфатирование?
Для исследования кинетических закономерностей процесса фосфатирования существует 3 метода:
- Гравиметрический — количественное определение массы фосфатов в единицу времени;
- Электрохимический — определение свободных реакционных зон покрытия и непрокрытых участков с помощью электрохимической пассивации;
- Рентгенофазовый — определение интенсивности рентгеновского излучения полученного соединения.
Все три метода дали схожую картину процесса, а именно: формирование пленки происходит не линейным образом, а очень быстро вначале процесса и постепенно затухает вплоть до полного прекращения.
Имеется 4 стадии формирования фосфатного покрытия (рисунок 3):
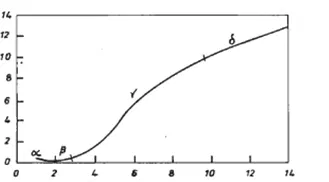
Время, мин.
Рисунок 3 — Четыре стадии фосфатирования, где: α - индукционная ступень (разрушение оксидных пленок, оставшихся после подготовки поверхности); β — начало роста пленки (формирование первых зародышей и резкое увеличение скорости зародышеобразования, рост пленки); γ — экспоненциальная стадия роста (рост пленки на непрокрытых участках); δ — стадия линейного увеличения толщины пленки.
Скорость зародышеобразования зависит от свойств поверхности, качества подготовки и состава ванны. Использование ускорителей сокращает индукционный период и увеличивает стадию линейного увеличения толщины.
В целом, скорость фосфатирования зависит от интенсивности диффузии ионов Fe2+ из кристаллической решетки к покрытию/раствору. Скорость реакции определяется равенством:
-dFA/dt = K∙FAdt,
где:
dt — изменение времени;
FA — поверхность анодов в микроячейках;
K — константа скорости реакции.
Скорость образования фосфатной пленки зависит главным образом от соотношения FAo, то есть первоначальной площади микроанодов, к FA — площади анодов в любой момент времени. Влияние других факторов (температура, состояние поверхности и т.п.) отражается в значении константы скорости К, которая индивидуальна для каждого процесса.
Продолжительность обычного горячего фосфатирования может составлять 40-120 минут. Для ускорения процесса были разработаны специальные добавки — ускорители.
Как ускорить процесс фосфатирования?
Процесс фосфатирования в растворах, содержащих однозамещенные фосфаты, особенно эффективно протекает при высоких температурах. Его продолжительность достигает 120 минут. Ускорение процесса возможно с помощью введения в раствор специальных добавок.
На практике реакция фосфатирования замедляется из-за поляризации, вызываемой выделением водорода на микрокатодах. Для ускорения образования пленки фосфатов используются различные методы: химические, механические и электрохимические.
Химическое ускорение. Окислители и металлы, стоящие правее железа в ряду напряжения металлов являются наиболее важными химическими ускорителями. Окислители деполяризуют катодные полуреакции за счет предотвращения накопления водорода на катодной поверхности, в то время как ионы других металлов увеличивают растворимость железа за счет уменьшения перенапряжения на катодных участках.
Проще говоря, окислители ускоряют анодную полуреакцию травления стали за счет замены сопряженной с ней катодной реакции выделения водорода на на другие процессы, протекающие легче. Кроме этого, исключается механическая блокировка поверхности стали водородом.
Ускорение через деполяризацию является предпочтительным, поэтому наибольшее распространение получило применение окислителей. Немаловажное достоинство окислителей – предотвращение чрезмерного накопления железа в ванне, что вредно для качества покрытия. Широко используемые окислители это: нитриты, нитраты, хлораты, органические нитридные соединения. Возможно использование смесей окислителей. В качестве эксперимента для ускорения были использованы и различные восстановители.
В присутствии окислительных ускорителей (Ох) реакция травления стали выглядит следующим образом:
Fe + 2Н+ + 2Oх → Fe2+ + 2НОх
Далее воозможны варианты реакций, в зависимости от природы окислителя:
4Fe + NaNO3 + 10H+ → 4Fe2+ + NH4+ + Na+ + 3H2O
Fe2+ + 2H+ + NaNO2 → Fe3+ + NO + Na+ + 2H2O
Fe + 1/2O2 + 2H+ → Fe2+ + H2O
3Fe + NaNO2 + 8H → 3Fe2+ + NH4+ + Na+ + 2H2O
3NO2- + 2Н+ → NO3- + 2NO + Н2O
3Fe + NaClO3 + 6H+ → 3Fe2+ + NaCl +3H2O
6Fe2+ + NaClO3 + 6H+ → 6Fe3+ + NaCl + 3H2O
Fe + H2O2 + 2H+ → Fe2+ + 2H2O
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
Все это идет на фоне небольшого выделения водорода.
Окислители непосредственно участвуют в электродных процессах на границе сталь-раствор, восстанавливаясь по электрохимическому механизму. Процесс в основном контролируется диффузионными ограничениями.
Рассмотрим механизм действия ускорителей подробнее. Рассмотрим диаграмму коррозии стали на рисунке 4. Использование ее справедливо, т.к. процесс фосфатирования, по сути, коррозионный, с водородной деполяризацией.
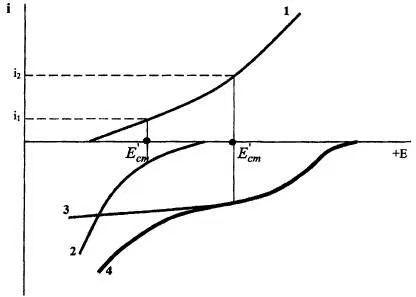
Рисунок 4 — Диаграмма коррозии стали в среде с двумя окислителями: 1 — анодная кривая окисления Fe; 2 — катодная кривая восстановления водорода; 3 — катодная кривая восстановления ускорителя; 4 — суммарная кривая восстановления водорода и ускорителя; 5 — i1, скорость окисления Fe в отсутствие ускорителя; 6 - i2 - скорость окисления Fe в присутствии ускорителя.
В качестве первого окислителя в рассматриваемой модели выступают ионы водорода, а в качестве второго — добавка или растворенный кислород:
- При отсутствии второго окислителя (кривые 1 и 2) потенциал коррозии Е1ст сильно смещается в отрицательную область относительно Ер водорода. Скорость травления железа, выраженная в плотности тока коррозии i1 мала. Процесс сопровождается выделением водорода.
- При введении второго окислителя кривые 2 и 3 складываются в кривую 4 за счет одновременного восстановления окислителей. При этом потенциал коррозии Е2ст смещается в положительную сторону. Скорость травления железа i2 увеличивается, за счет этого растет и скорость фосфатирования. Потенциал выделения водорода не достигается.
Введение окислителей смещает потенциал стали в положительную сторону на 50-100 мВ. При этом скорость наступления пассивации увеличивается в 5-6 раз.
Отдельно стоит рассмотреть действие фторидных ускорителей. Существует 2 точки зрения на механизм их действия.
По В. Маху действие фторидов описывается уравнениями:
• Первичная реакция травления:
3Fe + 3H2F2 → 3FeF2 + ЗН2
• Образование железистого криолита:
3FeF2 → Fe2[FeF6]
• Образование вивианита под действием свободной фосфорной кислоты:
Fe2[FeF6] + 2Н3РO4 → Fe3(PO4)2 + 3H2F2
Как видно, в ходе последней реакции плавиковая кислота высвобождается и снова расходуется в начальном этапе процесса. В состав плёнки фториды не включаются.
По другому мнению фториды изменяют кинетику электродных реакций при фосфатировании. Так, в присутствии фтористого натрия изменяется скорость травления стали за счёт изменения перенапряжения катодного процесса. Ускорению катодного процесса способствуют образующиеся в кислой среде ионы HF2-, которые могут выступать в качестве доноров протонов.
И наконец, ускоряющим действием могут обладать введеные в раствор некоторые тяжелые металлы. Они цементируются на поверхности стали и образуют новые микрокатодные зоны. В результате увеличивается ΔЕ между катодными и анодными участками и ускоряется травления железа. Это, как упоминалось ранее, определяюще влияет на скорость фосфатирования.
Механическое ускорение. При распылении раствора фосфатирования на поверхность металла, процесс образования фосфатной пленки протекает лучше, чем при погружении изделия в раствор. Это связано с отсутствием затрат времени на диффузию компонентов раствора к поверхности металла. При использовании распыления получаются тонкие, мелкокристаллические пленки, которые являются отличной основой для дальнейшей покраски. Другой вариант ускорения процесса – использование щеток и валиков для обработки поверхности детали в процессе фосфатирования.
Электрохимическое ускорение. Существуют анодные, катодные и импульсные методы ускорения. Катодный метод был применен в 1909 году Кослеттом. В качестве катода выступает само покрываемое изделие. За счет усиленного выделения водорода на катоде происходит увеличение скорости образования нерастворимых фосфатов, что приводит к интенсификации процесса фосфатирования в целом. Основные стадии катодного процесса:
- Изменение значения потенциала от начального до максимального;
- Максимальное значение потенциала изменяется на равновесное;
- Смещение значения потенциала от равновесного.
Последующие исследования показали, что анодные методы являются более совершенными и выгодными по сравнению с катодными, так как им свойственного ускоренное растворение металла. Для анодного метода характерно использование изделия в качестве анода. В то время, как на катоде происходит выделение водорода, на аноде-изделии происходит растворение металла.
Зантоут и Гейб сумели добиться более высокого удельного веса покрытия, низкой пористости за более короткое время анодного процесса при применении слабого тока.
Использование гальванопары железо-более благородный металл ускоряет растворение железа за счет коррозионных процессов и ускоряет реакцию со свободной фосфорной кислотой, что приводит к увеличению массы образующейся фосфатной пленки.
Доктором Bjerrum'ом был получен патент на фосфатирование нержавеющей стали с использованием раствора фосфатирования, модифицированного кальцием с применением катодного тока.
Все представленные методы ускорения процесса фосфатирования широко используются и имеют свои достоинства и недостатки. Использование окислителей является достаточно простым, но для получения качественного покрытия необходим постоянный контроль их концентрации в растворе. Механическое ускорение ограничено необходимостью постоянного обновления раствора для распыления. Электрохимические методы ускорения достаточно трудно встроить в уже существующий процесс, хоть они и увеличивают скорость осаждения покрытия.
3. В чем отличия механизма аморфного фосфатирования от кристаллического?
Аморфное фосфатирование идет с примененим первичных фосфатов щелочного металла или аммония, а не тяжелого металла. Все фосфаты щелочных металлов и аммония растворимы в воде, что в корне меняет механизм процесса. Между ними нет гидролизного равновесия. Щелочной металл не встраивается в структуру покрытия, структурный катион образуется при травлении подложки:
Fe + 4NaH2PO4 → Fe(H2PO4)2 + 2Na2HPO4 + H2
Повышение рН в приповерхностном слое, за счет травления железа, запускает следующие необратимые реакции:
2Fe(H2PO4)2 + 2Na2HPO4 + 1/2O2 = 2FePO4 + 4NaH2PO4 + H2O
или
2Fe(H2PO4)2 + 2Na2HPO4 + 3/2O2 + 3H2O = 2Fe(OH)3 + 8NaH2PO4
2Fe(OH)3 → Fe2O3 + H2O
В ходе процесса также образуется гидрофосфат щелочного металла. Все нерастворимые продукты реакций встраиваются в покрытие. Общий процесс прекращается при рН>6.
В литературе встречается еще 3 механизма аморфоного фосфатирования?
Первый:
4Fe + 4NaH2PO4 + 2O2 → Fe3(PO4)2 + FeO + 2Na2HPO4 + 3H2O
Второй:
4Fe + 4NaH2PO4 + 3O2 → 2FePO4 + Fe2O3 + 2NaH2PO4 + 3H2O
Третий:
Fe + 2NaH2PO4 + 1/2O2 → FeHPO4 + Na2HPO4 + H2O
2Fe + 3/2O2 - Fe2O3
4. Состав и структура фосфатных покрытий.
Как исследуют фосфатные пленки? Для определение структуры и характеристик фосфатной пленки используют:
- Сканирующую электронную микроскопию (СЭМ). С помощью СЭМ можно определить морфологию и размер кристаллов покрытия, а также проследить постадийное течение процесса (образование зародышей, рост пленки и т.д.).
- Рентгеноспектральный анализ (РСА) используется для определения пористости покрытия, т.е. участков меди, образующихся после погружения готового изделия в раствор сульфата меди.
- Рентгенодифракционный анализ (РДА) используется для определения фазового состава покрытия на различных участках изделия и пространственной ориентации кристаллов гопеита.
- Ожэ-электронная спектроскопия (ЭОС) высокого разрешения и рентгеновская спектрометрия могут быть использованы для анализа на содержание Cr(III) после пассивации фосфатного покрытия.
- Рентгеновская фотоэлектронная спектроскопия (РФЭС) используется для определения природы различных частиц фосфатного покрытия.
- Электронный спиновый резонанс (ЭСР) применяется для подтверждения изменения структуры изделия и образования гопеита на поверхности.
- Также при изучении структуры фосфатных пленок применяются дифференциальный термический анализ (ДТА), инфракрасная спектроскопия (ИКС), Рамановская спектроскопия, дифференциальная сканирующая калориметрия (ДСК), атомно-силовая микроскопия (АСМ), акустическая эмиссия и другие.
Из чего состоит фосфатное покрытие?
Основными компонентами фосфтаных пленок, в зависимости от состава раствора и условий осаждения, являются:
- фосфофиллит Zn2Fe(PО4)2·4H2О;
- гопеит Zn3(PО4)2·4H2О;
- гопеит, модифицированный марганцем (псевдофосфоллит) Zn2Mn(PО4)2·4H2О;
- вивианит Fe3(PО4)2·8H2О;
- хуреалит марганца Mn5H2(PО4)2·4H2О;
- хуреалит железа Fe5H2(PО4)4·4H2О;
- шольцит Zn2Ca(PО4)2·2H2О.
Какова структура фосфатных покрытий?
Основным параметром фосфатного покрытия является его плотность (масса). Приняты следующие оптимальные значения плотности (г/м2):
- 1-5 - под ЛКП (оптимальный размер кристаллов 3-15 мкм);
- 1,5-4,0 - под электрофоретическое окрашивание;
- 5-20 - под холодную деформацию;
- 10-30 - как антикоррозионное (оптимальный размер кристаллов 50-100 мкм);
- 5-15 - как противоизносное.
Толщина фосфатных пленок зависит от способа их получения, состава обрабатываемого материала и его подготовки перед фосфатированием:
- На полированной поверхности стали образуются мелкокристаллические пленки толщиной 2-4 мкм;
- В горячих растворах можно получить крупнокристаллические пленки толщиной от 10 до 100 мкм;
- В растворах для холодного фосфатирования получаются пленки до 6 мкм.
Размеры деталей при фосфатировании меняются незначительно, т.к. наряду с ростом фосфатного слоя происходит уменьшение толщины металла за счет травления.
Существует связь между толщиной пленки и ее структурой. Зерна кристаллического покрытия во время роста смыкаются, что изолирут стальную поверхность от раствора фосфатирования. Поэтому толщина крупнокристаллических пленок больше, чем мелкокристаллических. Пористость покрытия также коррелирует с размером кристаллов.
Внешне структура фосфатных покрытий может выглядеть совершенно различным образом.
Для кристаллических покрытий типичными являются иглообразная и сфероидальная структура (рисунок 5).


Рисунок 5 — Примеры иглообразной и сфероидальной структуры фосфатных покрытий.
Аморфные фосфатные пленки гладкие, внешне не имеют кристаллического строения и являются рентгеноаморфными. При более детальном их изучении обнаруживается, что они микрокристалличны, с очень развитой поверхностью, чем и объясняется их высокая адгезия к ЛКП.
Цвет фосфатных покрытий зависит не только от условий их получения, но и от материала подложки:
- Углеродистая сталь без травления - светло-серый;
- Высокоуглеродистая сталь, чугун, травленные поверхности - темно-серый, черный;
- Стали, легированные хромом и никелем - зеленовато-серые.
На цвет аморфных пленок дополнительно влияет их плотность (г/м2).
- 0,11-0,16 - голубой;
- 0,16-0,38 - средне-синий;
- 0,27-0,38 - синий с лёгким верхним золотистым внешним слоем;
- 0,38-0,54 - синий с розово-золотистым внешним слоем;
- 0,54-0,81 - розово-золотистый;
- > 0,81 - фиолетово-золотистый.
5. Влияние различных факторов на свойства фосфатного покрытия.
• Природа поверхности основы. Наличие легирующих элементов и их химическая природа приводят к определенным различиям качества фосфатной пленки. Стали с небольшим количеством легирующих добавок (хрома, никеля, молибдена и ванадия) фосфатируются просто и без проблем. Однако, если концентрация этих элементов превышает некую границу, происходит уменьшение интенсивности процесса и ухудшение качества пленки. Из перечисленных элементов превышение количества хрома является самым пагубным. Склонность к фосфатированию холоднокатаных сталей с различным содержанием легирующих элементов приведена в таблице ниже.
|
Cu + Ni + Cr (ppm) |
Шероховатость Ra, мкм |
Качество пленки* |
Удельный вес, г/м2 |
|
300 |
<0,8 |
1 |
4,1 |
|
200 |
>1,2 |
1 |
4,7 |
|
800 |
<0,8 |
5 |
3,0 |
|
1000 |
>1,2 |
4 |
3,6 |
*Визуальная оценка. 1 – хорошо; 5 – ужасно.
Количество углерода, серы, фосфора, марганца и кремния в стали также влияет на фосфатируемость. Низкоуглеродистые стали относительно легко покрываются качественной фосфатной пленкой. С увеличением содержания углерода, уменьшается скорость процесса и увеличивается размер кристаллов покрытия. Присутствие кристаллов феррита облегчает протекание процесса, перлит создает сложности в образовании кристаллов.
Хотя каждый элемент влияет на процесс фосфатирования по своему, наиболее неблагоприятной примесью являются карбидообразующие элементы (хром, вольфрам). Говоря об углероде, считается что оптимальное содержание его в стали находится в пределах от 4,3 мг/м2 до 6,4 мг/м2.
• Структура поверхности металла. Для процесса фосфатирования положительным фактором является высокая шероховатость поверхности. Чем она выше, тем больше удельный вес покрытия и короче время обработки. Рекомендуется средняя шероховатость поверхности перед фосфатированием в пределах от 0,76 – 1,77 мкм. Отполированные стальные поверхности фосфатируются достаточно тяжело, и качество получаемой пленки остается под вопросом. Сложный профиль также положительно влияет на качество получаемого покрытия. Не последнюю роль играет строение кристаллической решетки (α-Fe является оптимальным состоянием).
• Подготовка поверхности. Обезжиривание в органических растворителях способствует образованию мелкозернистых покрытий, тогда как применение сильно-щелочного обезжиривания или травления приводит к образованию грубых, крупных зерен. Хотя использование ингибиторов травления уменьшает вред от данного процесса, фосфатирование после травления затрудняется до момента очистки поверхности от ингибитора с помощью сильно-щелочных растворов.
Термическая и механическая обработка. Термическая и термохимическая обработка приводит к образованию гетерогенных фаз, которые впоследствии влияют на размер зерна. При отжиге стали, содержащей 0,3 % марганца и 0,2% титана в атмосфере азота-водорода при температуре 280 °С, происходит образование на поверхности оксидов марганца и титана, что в свою очередь облегчает процесс фосфатирования. При нагревании в данных условия в течение 2-х минут, увеличиваются удельный вес покрытия и размер зерна, но снижается адгезия краски к фосфатной пленке (крупнокристаллический осадок). При более длительном нагреве происходит диффузия марганца от объема изделия к поверхности, что облегчает процесс фосфатирования. Постепенный нагрев металла при изготовлении детали предпочтительнее, чем резкое увеличение температуры (закалка может негативно влиять на процесс фосфатирования). Механическая обработка, например, пескоструйная серьезно облегчает процесс фосфатирования и увеличивает скорость осаждения покрытия.
• Состав ванны фосфатирования. Высокая концентрация ионов тяжелых металлов позволяет получать покрытия с высокой защитной способностью. Для получения покрытий высокого качества необходимо поддерживать заданные значения общей и свободной кислотности и их соотношение. При превышении заданного количества фосфорной кислоты увеличивается время покрытия и происходит перерасход металла. При уменьшении разности значения pH начала и окончания процесса фосфатирования (введение тяжелых металлов и растворителей) происходит ускорение процесса.
Концентрация ускорителей также важный параметр процесса. При маленьком количестве ускорителей, серьезно увеличивается время фосфатирования, а при избытке возможна полная пассивация поверхности изделия и остановка процесса. При добавлении ПАВ в ванну, необходимо оптимизировать количество ускорителя. Добавление специфических соединений оказывает влияние на процесс. Например, введение ионов кальция приводит к значительным изменениям в кристаллической структуре, удельном весе покрытия и его коррозионной стойкости. А именно, структура покрытия превращается из фосфалит-гопелита в шользит-гопеита, размер зерен находится в пределах от 25 до 4 мкм. Введение марганца и никеля приводит к улучшению коррозионных свойств покрытия.
Влияние постоянного магнитного поля не оказывает существенного влияния на процесс покрытия, но по результатам исследований действие перпендикулярно направленного поля привод к слабому увеличению размеров зерна и уменьшению коррозионной стойкости.
В последнее время ведутся работы по изучению влияния электро- и механического воздействия на процесс. Электрохимическое ведение процесса достаточно затруднительно, но осуществимо и имеет смысл. Механическая вибрация стали в процессе фосфатирования уменьшает размер кристаллов покрытия, но пропорционально уменьшает его удельный вес. Ультразвуковая кавитация способствует образованию большого количества активных центров и увеличивает скорость зародышеобразования, а значит и процесса в целом. Результатом применения УЗ становится равномерное мелкозернистое покрытие с низкой пористостью.
6. Основные проблемы процесса и рекомендации по их решению.
Поддержание параметров ванны на оптимальном уровне достаточно серьезный и сложный процесс, особенно при непрерывном и крупномасштабном фосфатировании. Возникают ситуации, когда ванна не работает в заданном режиме. Перегрев ванны, избыточная кислотность, изменение кислотности из-за избытка щелочи, перенесенной из раствора подготовки, локальные перегревы и т.п. Ванны, применяемые длительное время, оказываются не эффективными из-за образования осадка фосфата железа.
Наиболее часто встречаемые дефекты фосфатного покрытия это:
- низкая общая коррозионная стойкость изделия;
- низкий удельный вес покрытия;
- неравномерная коррозионная стойкость различных частей детали с покрытием;
- рыхлый белый осадок на поверхности.
Возможные причины дефектов это:
- недостаточное обезжиривание и очистка поверхности;
- несоответствующее значение свободной кислотности;
- неправильный состав раствора;
- низкое качество реактивов, используемых при приготовлении раствора;
- несоответствие температуры;
- наличие примесей в растворе: алюминий, сурьма, соединения олова и свинца, хлорид-ионы;
- неправильное расположение изделий в ванне и превышение соотношения покрываемой поверхности к объему раствора.
7. Оценка качества фосфатной пленки.
Основные параметры, определяемые в системе контроля качества для фосфатного покрытия это физические свойства и коррозионная стойкость покрытия.
• Осмотр внешнего вида. Цвет фосфатного покрытия может варьироваться от светло-серого до темно-серого в зависимости от состава раствора и вида стали.
• Определение толщины и удельного веса. Толщина фосфатного покрытия обычно определяется магнитным, электромагнитным или микроскопическим методами. Широко используются разрушающие методы контроля удельного веса покрытия. Метод гравиметрии заключается в измерении разности веса покрытого изделия и изделия после растворения покрытия. Для снятия покрытия могут быть использованы: раствор концентрированной соляной кислоты, содержащий 20 г/л триоксида сурьмы при комнатной температуре; 5% раствор хромового ангидрида при комнатной температуре; и 20% раствор гидроксида натрия при температуре 90 оС. Удельный вес покрытия выражается в г/м2 покрытия.
• Определение кислотостойкости. Рассчитывается как разность веса детали до фосфатирования и после снятия покрытия.
• Оценка физических свойств. Абсорбционная способность и гигроскопичность важные параметры фосфатной пленки. Оценка абсорбционной способности включает измерение увеличения удельного веса покрытия после погружения и выдержки в диацетоновом спирте в течение двух минут и стекании раствора в течение трех минут. Гигроскопичность оценивается по увеличению веса покрытия после выдержки в закрытом контейнере с влажной атмосферой при комнатной температуре в течение 6 часов.
• Оценка пористости. Производится химическими и электрохимическими методами. Химический метод основан на образовании синих пятен на поверхности изделия (Берлинская лазурь) после пятиминутной выдержки детали в растворе хлорида натрия и железосинеродистого калия. Мерой пористости является количество синих пятен на см2 поверхности. Электрохимический метод основан на измерении плотности тока в процессе выделения кислорода при погружении изделия в насыщенный раствор гидроксида натрия (pH = 12). Хотя оба метода используются в промышленности, электрохимический считается наиболее простым и быстровыполнимым.
• Термическая и химическая стойкость. Термическая стойкость определяется путем расчета потери веса покрытия в процессе сушки при температуре 120 и 180 оС. Химическая стойкость к щелочи определяется как процент остаточного покрытия после погружения изделия в щелочной раствор.
• Морфология поверхности. Обычно оценивается с помощью сканирующей электронной микроскопии (СЭМ). Данный метод позволяет определить кристаллическую структуру, размер зерна кристаллов и степень однородности покрытия.
• Определение фосфатного соотношения (P). Для покрытия в составе которого в основном находятся гопеит и фосфолит фосфатное отношение рассчитывается как:
Рсоотн=Р/(Р+H)
где:
P — количество фосфолита,
H — количество гопеита.
• Адгезионные испытания. Для проверки адгезии в лабораторных условиях используется адгезионная лента, стирательная резинка и пластмассовая пластина. В зависимости от степени отслоения покрытий качество адгезии может быть оценено от 0 до 5 баллов. После сильного царапания покрытия ногтем должна наблюдаться белая полоса, не разрушившая покрытие. При проведении белым ластиком по поверхности покрытия не должно наблюдаться изменение цвета ластика.
8. Влияние на окружающую среду и обращение с отходами фосфатирования.
Для процесса фосфатирования, как и для большинства процессов обработки металлов, может быть характерно образование опасных отходов. Отходы, образующиеся в процессе фосфатирования можно разделить на жидкие (травление, обезжиривание, промывки) и твердые (шламы процесса фосфатирования). Общий объем сточных вод на среднестатистическом предприятии составляет 20,8 г/м2 покрываемой поверхности, а твердых шламов 49 г/м2 обрабатываемой поверхности. В процессе фосфатирования выделяется 400 г/м2 углекислого газа. Вещества, используемые в процессе фосфатирования, имеют средний уровень токсичности, а значит, не наносят тяжелого вреда здоровью человека.
Стоит заметить, что при грамотной организации техпроцесса фосфатирования отходов может вообще не образовываться.
Во всем мире за счет процессов фосфатирования образуется 50 млн. тонн фосфатного шлама в год. Основные компоненты шлама: соединения железа 20% масс., цинка 10% масс., марганца 1-3% масс., никеля <1% масс., фосфаты 50-55% масс. Основные направления переработки таких шламов - это извлечение полезных компонентов для повторного использования в качестве реактивов при приготовлении раствора фосфатирования. Основной метод переработки шлама – пирометаллургическая обработка, восстановительные процессы спекания для восстановления цинка, железа и никеля, с последующим выщелачиванием.
В США получен патент на переработку фосфатного шлама с обработкой его фосфорной кислотой, последующей жидкостной экстракцией железа и получением экстракта цинка с фосфатным раствором, который может быть повторно использован в процессе фосфатирования. Аналогичный патент существует и в Британии, но дополнительно предлагает выщелачивать фосфаты из нерастворимого осадка.
Другой интересный вариант, это использование фосфатного шлама после соответствующей обработки в качестве смазочной добавки.
Читайте также статьи
Заказать химическое фосфатирование (Хим.Фос)
Сделать заказ фосфатирования с сертификатом качества на заводе.
Механизм анодирования
Анодное оксидирование алюминия. Механизмы процесса.
Цинкование стали
Механизм и технология гальванического процесса.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



