

Механизм и технология анодирования Ан.окс. Структура и свойства оксида алюминия в покрытии.
Содержание:
1. Общие сведения об анодировании (анодном оксидировании) алюминия.
2. Состав и структура оксида алюминия в покрытии.
3. Теории образования пленок оксида алюминия.
4. Особенности роста оксида алюминия при анодировании.
5. Свойства оксидных покрытий на алюминии.
6. Уплотнение и окрашивание анодных оксидных пленок на алюминии.
7. Цветное анодирование алюминия
8. Анодирование с упорядоченной архитектурой микропор
1. Общие сведения об анодном оксидировании (анодировании) алюминия.
Поверхность алюминия и его сплавов ввиду склонности к пассивации постоянно покрыта естественной окидной пленкой. Толщина пленки зависит от температуры окружающей среды и составляет обычно 2-5 нм. Коррозионную и механическую прочность алюминия можно увеличить в десятки и сотни раз, подвергая его электрохимическому оксидированию (анодированию).
Анодирование — это процесс получения из алюминия защитной оксидной пленки. Производится электрохимическим методом в водных растворах. Плотность такого покрытия составляет 2,9-3,8 г/см3, в зависимости от режима получения.
Назначение покрытия — защита изделий от коррозии, увеличение износостойкости, придание декоративного внешнего вида (при наполнении красителями)
|
Обозначение |
Ан.Окс — анодирование без дополнительных требований; Ан.Окс.нв — с наполнением в воде; Ан.Окс.нхр — с наполнением в растворах хроматов; Ан.Окс.(цвет красителя) — с наполнением в красителе, пример - Ан.окс.ч; Аноцвет — цветное анодирование, полученное непосредственно из ванны; Ан.Окс.тв — твердое; Ан.Окс.эиз — электроизоляционное; Ан.Окс.эмт — эматаль; Ан.Окс.эмт. (цвет красителя) — эматаль с наполнением в красителях, пример - Ан.окс.эмт.ч; Ан.Окс.хр — анодирование из хромовокислого электролита. |
|
Толщина покрытия |
6-40 мкм (для Ан.окс.тв толщина выше). |
|
Микротвердость (зависит от марки сплава алюминия) |
1960-2450 МПа — Д1, Д16, В95. 2940-4900 МПа — А5, А7, А99, АД1, АМг2, АМг2с, АМг3, АМг5, АМг6, АМц. 4900 МПа — для эматалиевого покрытия. |
|
Удельное электрическое сопротивление при 18°C |
1012 Ом⋅м |
|
Допустимая рабочая температура |
100° C (возможно увеличение при наполнении красителями) |
Анодно-оксидные покрытия разделяют на следующие группы:
- защитные (9-40 мкм) - предъявляются требования только по коррозионной стойкости;
- защитно-декоративные (9-40 мкм) - важна не только коррозионная стойкость, но и внешний вид (сюда же можно отнести цветные и окрашенные покрытия);
- твердые (обычно >90 мкм) - в первую очередь нужна повышенная микротвердость поверхности. Могут также выполнять функцию электроизооляционных);
- электроизоляционные (40-90 мкм) - оценивается величина пробивного напряжения;
- тонкослойные (до 9-15 мкм) - используются, как правило, под окраску, либо для сохранения глянца поверхности после покрытия;
- эматаль.
- покрытия с комбинированными свойствами.

Рисунок 1 — Анодирование металла. Пример.
Ан.окс.тв — это твердое анодирование алюминия, которое отличается от стандартного покрытия Ан.Окс высокой толщиной и особенностями процесса нанесения. В ряде случаев у твердого покрытия толщина достигает сотен микрометров, тогда как в обычном покрытии она измеряется десятками. Высокая толщина и твердоть Ан.Окс.тв обеспечивает непревзойденную износостойкость поверхности алюминия.
В качестве электролитов применяются:
- Малоагрессивные фосфорная, лимонная, борная кислота;
- Агрессивные серная, сульфосалициловая кислота, хромовый ангидрид.
Анодирование металла всегда идет при повышенном напряжении, чаще всего от 12 до 120 В. Иногда напряжение может достигать огромных для гальваники значений - до 600 В.
Выделяющиеся на аноде продукты реакции могут:
- Полностью растворяться (покрытие не образуется);
- Создавать на поверхности металла прочно сцепленное тончайшее (десятки нанометров) компактное электроизоляционное оксидное покрытие;
- Частично растворяться в электролите и образовывать пористое оксидное покрытие толщиной в десятки и сотни микрометров.
После нанесения пористое покрытие может оставаться "как есть", уплотняться в воде, либо наполняться. В первом случае покрытие прекрасно подходит под нанесение лакокрасочных материалов и оклеивание. Во втором покрытие сохраняет серебристый цвет и становится более коррозионно-стойким. В третьем случае покрытию можно придать цвет без нанесения лакокрасочных материалов. Подробнее об этом написано в разделе 6.
2. Состав и структура оксида алюминия после покрытия.
Аноднооксдные покрытия на алюминии могут быть тонкими беспористыми и толстыми пористыми.
При получении тонких покрытий в слабых малоагрессивных электролитах, на поверхности металла образуется оксид по реакции:
2Al + 3H2O - 6e → Al2O3 + 6H+
Иллюстрация реакции приведена на рисунке 2.
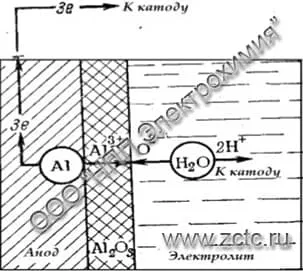
Рисунок 2 — Схема образования тонкой оксидной плёнки в малоагрессивных электролитах.
Все эти растворы работают при высокой температуре от 70 до 95° С, необходимой для повышения электропроводности раствора и снижения затрат электроэнергии. И все-же напряжение на ванне остается весьма значительным - 150-600 В. Продолжительность обработки составляет 15-30 минут, а толщина покрытий не превышает долей микрона. Ввиду малой пористости тонкие анодно-окисные покрытия окрашиваются плохо.
Толстые пористые аноднооксидные покрытия получают из агрессивных растворов (например, из раствора серной кислоты). В покрытиях, полученных из агрессивных электролитов, обычно выделяют два слоя (рисунок 3):
- Тонкий беспористый барьерный слой, прилегающий к металлу (1), формирующийся из условия 0,008 - 0,012 мкм на 1 В приложенного напряжения, и обычно составляющий 0,01 - 0,03 мкм.
- Толстый пористый слой (2), представляющий собой систему конусообразных пор, пронизывающих оксидную пленку, и имеющий толщину от нескольких микрометров до миллиметров.
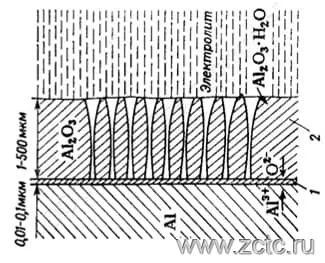
Рисунок 3 — Структура слоев оксида алюминия, полученного из агрессивных электролитов.
Структура толстого пористого аноднооксидного покрытия подтверждается результатами электрохимической импедансной спектроскопии (рисунок 4).

Рисунок 4 — Графики Боде для алюминия марки Al 6061, анодированного в сернокислом электролите с последующим уплотнением в воде при погружении их в 3,5% раствор хлорида натрия на указанное время. Слева - модуль Боде, справа - фаза Боде.
На графиках модуля Боде прослеживается следующие области:
- Высокие значения импеданса на частотах ≤ 1 Гц четко указывают на характеристики барьерного слоя анодного покрытия.
- Квази-горизонтальная область в графике модуля Боде и соответствующая область минимума в графике фазы Боде характеризуют поведение сопротивления пористого слоя.
- Крутая часть при более высоких частотах на графике модуля Боде характеризует емкостное поведение пористого слоя.
Эквивалентная электрическая схема пористого аноднооксидного покрытия с уплотнением в воде приведена на рисунке 5.
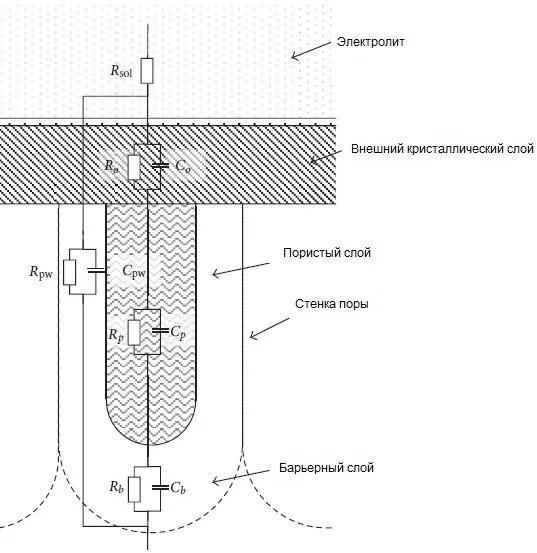
Рисунок 5 — Эквивалентная электрическая схема пористого аноднооксидного покрытия с уплотнением в воде: Rsol - сопротивление электролита, Ro и Co - сопротивление и емкость внешнего кристаллического слоя, Rpw и Cpw - сопротивление и емкость стенки поры, Rp и Cp - сопротивление и емкость тела поры, Rb и Cb - сопротивление и емкость барьерного слоя.
Что касается состава анодно-оксидных покрытий, то тонкие беспористые пленки представляют собой в основном безводный оксид алюминия, который в чистом виде располагается у границы с металлом. В покрытия такого типа внедряется от 0,6 до 20% борного ангидрида (электролиты с борной кислотой), а также значительное количество других ионов. На границе раздела оксид-электролит находят небольшую часть гидратированного оксида Al2O3*H2O (бемит).
Толстые пористые анодно-оксидные покрытия состоят в основном из аморфного оксида алюминия и, частично, γ-Al2O3. В ходе гидратации оксида, за счет поступления электролита по порам к их дну, может происходить как физическая адсорбция воды, так и образование фазы бемита Al2O3*H2O или байерита Al2O3*3H2O. Общее содержание воды в покрытиях, полученных из сульфатных электролитов, достигает 15%, барьерный слой при этом может содержать воды до 2%. Гидратация стенок усиливается от дна к устью. Большинство исследователей склоняется к мнению, что вода в покрытии химически не связана, за исключением поверхностных слоев, где она входит в состав бемита.
Толстые покрытия содержат также значительное количество анионов электролита - до 20%. Например, массовая доля сульфатов может достигать 14 %. Ионы электролита распределены в пленке неравномерно: большая часть сульфат-ионов расположены в поверхностных слоях оксидного слоя (до 0,5 мкм), на протяжении большей части пористого слоя содержание сульфат-ионов постоянно (примерно 10%), и в барьерном слое ионы электролита отсутствуют. 50-60% анионов удерживаются капиллярными силами в порах, остальные прочно связаны с оксидами и распределены достаточно равномерно по толщине покрытия. Последние называют структурными анионами.
Примеси металлов, содержащиеся в сплавах алюминия, в большинстве своем остаются в оксидной пленке (железо, медь, кремний, магний, кальций). Цинк и титан присутствуют в виде следов с содержанием 0,1%.
В цветных оксидных пленках обнаруживаются включения углерода, серы и их оксидные соединения, которые и придают окраску.
Большая часть ионов не удаляется из покрытия ни длительной промывкой водой при высокой температуре, ни использованием других растворителей. Такая высокая прочность связи ионов с веществом анодной пленки при отсутствии простых стехиометрических соотношений между внедрившимся ионом и оксидом алюминия свидетельствует о внедрении ионов в элементарные образования пленки. По-видимому, часть анионов удерживается капиллярными силами в порах покрытия, другая часть химически связана со стенками пористого слоя.
С увеличением количества примесей в металле, повышением температуры электролита и плотности анодного тока увеличивается нерегулярность микроструктуры оксидных покрытий - нарушается перпендикулярность роста ячеек и пор, их параметры становятся более неравномерными. Наиболее хаотичная структура наблюдается в пленках, сформированных на алюминиевых сплавах в растворах хромовой и ортофосфорной кислот.

Рисунок 6 — Исходная поверхность алюминия до анодирования.

Рисунок 7 — Поверхность алюминия с оксидом, после анодирования в сернокислом электролите.
Как видно из рисунков 4 и 5 после анодирования на поверхности алюминия исчезают микронеровности, вызванные механической обработкой. При этом формируется плотная пористая оксидная пленка.
Если разделить пористый и барьерные слои, то можно увидеть седующую картину (рисунок 8):

Рисунок 8 — Пример поверхности алюминия, анодированного промышленным способом: а - реплика пористого слоя, b - реплика барьерного слоя, с - схематичное изображение.
3. Теории образования пленок оксида алюминия при анодировании.
Существуют две теории образования и роста анодно-оксидных покрытий: структурно-геометрическая и коллоидно-электрохимическая.
3.1 Структурно-геометрическая теория (ячейки Келлера).
С позиции этой теории при наложении на алюминиевый электрод анодного напряжения (т.е подключения его к "плюсу") сначала формируется компактная оксидная пленка (барьерный слой толщиной 1-1,1 нм/В), имеющая гексоганальную ячеистую структуру, причем растущее покрытие будет повторять ее.
Наружная часть ячеек в агрессивных электролитах, растворяющих оксид, начинает разрушаться в дефектных местах и превращаться в пористое покрытие. Разрушение барьерного слоя, приводящее к образованию поры, протекает, по мнению одних исследователей, в центре ячейки, по мнению других – в местах стыка ячеек.
Таким образом, под влиянием локальных воздействий ионов электролита в барьерном слое зарождаются поры, число которых обратно пропорционально напряжению. Диаметр пор и их число зависят от природы электролита и режима процесса. В поре толщина барьерного слоя уменьшается, и, как следствие, увеличивается напряженность электрического поля, при этом возрастает плотность ионного тока вместе со скоростью оксидирования. Но, поскольку растет и температура в поровом канале, способствующая вытравливанию поры, наступает динамическое равновесие, и толщина барьерного слоя остается практически неизменной. Размер ячеек увеличивается с ростом формирующего напряжения. Пример ячейки Келлера приведен на рисунке 9. Форма поры у разных авторов разнится - от круглой до "звездочки".
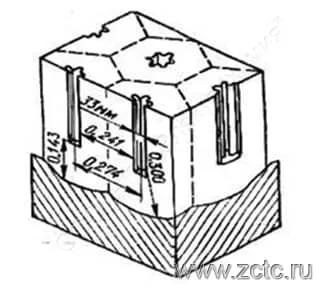
Рисунок 9 — Ячейка Келлера.
Рост анодно-оксидного слоя происходит на дне образовавшихся пор за счет превращения все более глубоких слоев металла в оксид. В дальнейшем под действием электролита оксид, образующий стенки ячеек, гидратируется. При этом происходит адсорбция воды, анионов электролита и продуктов анодной реакции.
3.2 Коллоидно-электрохимическая теория Богоявленского.
Наличие в составе оксидного слоя анионов электролита заставило ученых связать рост и особенности его строения с коллоидной структурой.
С позиции теории Богоявленского (рисунок 10) образование анодно-оксидных пленок начинается с возникновения мононов - мельчайших частиц оксида с адсорбированными анионами электролита. Зарождение мононов происходит в результате встречи потоков ионов. Мононы - зародыши будущих мицелл.
С увеличением числа мононов они превращаются в полиионы - волокнистые палочкообразные мицеллы коллоидной степени дисперсности, которые образуют скелет ориентированного геля оксида алюминия. В него внедряются анионы электролита, теряя частично при этом свою гидратную оболочку.
Адсорбция анионов и воды, осуществляемая по межмицеллярным порам, обуславливает отрицательный заряд монон и мицелл, заставляя их плотно прижиматься к аноду и сращиваться с металлом, препятствуя слиянию мицелл в беспористый слой. Поры при таком рассмотрении представляют собой естественное межмицеллярное пространство.
Наряду с процессами образования мицеллярных слоев с участием анионов протекают сопряженные процессы растворения образующегося оксида.
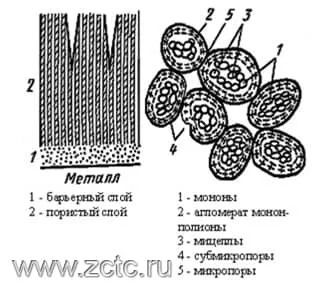
Рисунок 10 — Иллюстрация теории Богоявленского.
Интересно отметить, что размеры ячеек Келлера близки размерам мицелл геля Al(OH)3. Толкование механизма роста анодной пленки с позиций коллоидной химии позволяет объяснить внедрение в ее структуру анионов и катионов электролита и отдельных составляющих оксидируемого сплава. При этом сопряжение процессов образования оксида и его растворения в электролите также учитывается коллоидной теорией.
3.3 Современные исследования структуры покрытия.
Теперь следует заметить, что структура анодированного алюминия, на самом деле, может быть весьма далека от идеальной, описанной в теории. В частности теория говорит о правильных гексагональных ячейках, в центре которых находится одна пора. На самом деле, получить такую структуру можно только специальными методами, например, многостадийным анодированием в определенных режимах. Примеры таких "правильных" покрытий приведены на рисунке 11. Более глубокое описание наноструктурированного аноднооксидного будет приведено ниже.

Рисунок 11 — Примеры идеальных и близких к идеалу ячеек пористого слоя в аноднооксидном покрытии на алюминии.
Чаще же можно наблюдать более "грязные" варианты. Примеры их были показаны в начале статьи.
Кроме этого, теории не предполагают возможности ветвления пор, что наблюдается в действительности.
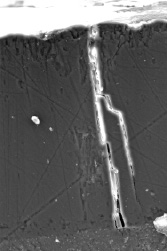
Рисунок 12 — Пример ветвления пор
4. Особенности роста оксида алюминия при анодировании.
Формирование оксидного слоя протекает на дне пор, где препятствием для прохождения электрического тока служит только тонкий барьерный слой, толщина которого практически не меняется в процессе обработки. С этой точки зрения можно наращивать толщину оксидного слоя без существенного увеличения напряжения на ванне. Образующиеся поры имеют форму конуса, расширяющегося к внешней стороне покрытия, поскольку эта часть дольше подвергается агрессивному воздействию электролита.
Необходимо отметить, что формирование пористой структуры является необходимым условием роста оксидного слоя. Оксид алюминия является плохим проводником электричества, а поры, хотя и заполнены электролитом, имеют весьма малый диаметр, поэтому сопротивление анода во много раз выше сопротивления на катоде и сопротивления электролита. Изменение потенциалов самих электродов вследствие поляризации незначительно по сравнению с прикладываемым напряжением, поэтому изменение напряжения во времени при постоянной плотности тока определяется изменением омического сопротивления анода.
Если проводить процесс при постоянной плотности тока, т.е. при постоянной скорости формирования оксида, то рост пленки будет тормозиться возрастающим сопротивлением электролита в порах. Для дальнейшего роста требуется либо увеличение прилагаемого напряжения, либо растравливание пор. На практике преобладает второй фактор. Этому способствует значительное выделение теплоты в процессе анодного окисления, причем основная часть тепла выделяется в барьерном слое на дне пор. Считается, что при анодном оксидировании в 15% серной кислоте при 21°С и плотности тока 1,29 А/дм2 условия, создающиеся у основания пор, соответствуют 53% раствору серной кислоты при температуре, близкой к кипению (около 128 °С). Температура анода при этом повышается на 10-20° в зависимости от условий проведения процесса. Поэтому рост оксидной пленки при постоянной плотности тока сопровождается непрерывным увеличением скорости растворения оксида. Предельная толщина пленки достигается тогда, когда скорость ее образования под действием электрического тока станет равна скорости химического растворения электролитом. Чрезмерный перегрев электролита у основания пор и местное повышение его агрессивности может привести к растравливанию оксидного слоя и получению некачественных покрытий с повышенной пористостью и слабой адгезии к металлу.
Скорость растворения оксидной пленки в серной кислоте увеличивается с ростом температуры, при этом энергия активации растворения анодной пленки оценивается в 17 ккал/моль, что указывает на контроль скорости кинетическими стадиями химического процесса растворения. Скорость химического растворения оксида алюминия сравнительно велика, особенно в агрессивных растворах серной кислоты.
Усиленное растворение оксида стимулируют повышение концентрации агрессивной кислоты, температуры и продолжительности процесса:
- при 20°С в 20% растворе серной кислоты для технически чистого алюминия, сплавов Д16 и АЛ9 скорость растворения составляет 0,2, 0,14 и 0,18 г/дм2∙ч.
- при увеличении температуры электролита вдвое скорость растворения увеличивается в 6 - 7 раз.
- при увеличении концентрации серной кислоты с 180 до 350 г/л скорость растворения возрастает примерно на 15%.
Растворение оксида выражается не только в стравливании поверхностного слоя формирующегося покрытия, но и в увеличении его пористости. Присутствие в алюминиевых сплавах меди и магния также несколько увеличивает скорость растворения оксида в серной кислоте.
Таким образом, соотношение скоростей формирования оксида и его химического растворения предопределяет и толщину и структуру получаемых анодно-окисных покрытий на алюминии.
Ввиду того, что образующийся оксидный слой имеет высокое сопротивление, электрический ток в процессе оксидирования автоматически перераспределяется на те участки, где сопротивление меньше. Тем самым создаются условия для получения равномерного по толщине оксидного слоя на деталях сложной конфигурации. Поэтому рассеивающая способность электролитов для анодного оксидирования алюминия и его сплавов весьма высока. Однако следует учитывать, что при недостаточном отводе тепла от формирующегося покрытия возникает возможность локального растравливания отдельных участков покрытия, которая не будет компенсирована увеличением на этих участках плотности тока. Это приведет к локальным дефектам покрытия, вплоть до полного его отсутствия. Постепенно неудовлетворительные условия для формирования покрытия могут охватить и всю деталь.
Из-за частичного растворения металла основы при анодном оксидировании выход по току всегда меньше 100%. Он уменьшается с ростом температуры и продолжительности электролиза. Например, при оксидировании сплава Д16 в серной кислоте при температуре 7°С выход по току практически не зависит от времени и составляет 85%, но если процесс вести при 20°С, то выход по току падает с 50-60% в течение первых 20 мин до 15-30% при оксидировании в течение 90 мин. Расход электричества на газовыделение невелик и при умеренных плотностях тока (до 1-2 А/дм2) не превышает нескольких процентов, но может возрастать при увеличении плотности тока и количества легирующих элементов в обрабатываемом сплаве.
5. Свойства оксидных покрытий на анодированном алюминии.
5.1 Коррозионная стойкость и пористость.
Аноднооксидное покрытие на поверхности алюминия и его сплавов благотворно сказывается на его коррозионной стойкости во многих средах, где оксид более стоек, чем основной металл. Оно успешно защищают алюминий от атмосферной коррозии, в нейтральных и слабокислых растворах неорганических солей:
- стойкость анодно-окисных покрытий в морской атмосфере и морской воде подтверждена многолетней эксплуатацией оксидированных алюминиевых деталей.
- анодное оксидирование снижает коррозию алюминия в ацетилене, сернистом газе, борной кислоте и бензолсульфокислоте, этаноле и этанольных растворах.
- в присутствии влаги происходит гидратация покрытия по стенкам пор с образованием бемита или гидраргилита, что способствует увеличению веса покрытия, его уплотнению и снижению скорости коррозии во времени.
- в хлоридсодержащих средах коррозионный процесс имеет явно выраженный локальный характер, протекая по порам покрытия; он сопровождается образованием гидроксохлоридов алюминия переменного состава, постепенно переходящих в гидроксид, что также способствует постепенному закупориванию пор и замедлению коррозии.
На рисунке 13 показаны коррозионные кривые для чистого алюминия и алюминия с аноднооксидными покрытиями.
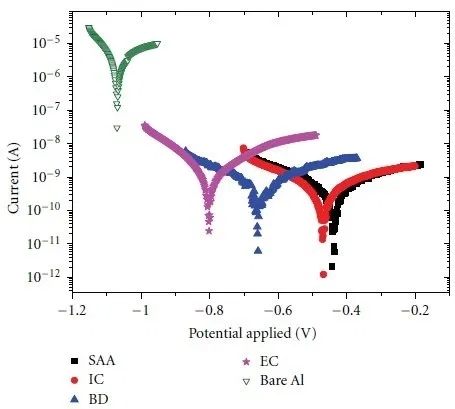
Рисунок 13 — Коррозионные кривые для чистого и анодированного алюминия: SAA - покрытие с уплотнением в воде, IC - покрытие с наполнением в неорганическом красителе, BD - покрытие с наполнением в органическом красителе, EC - электрохимическое окрашивание, Bare Al - чистый алюминий. Коррозионная среда - 3,5% раствор хлорида натрия.
Для чистого алюминия коррозионное сопротивление составляет 0,5953 кОм, ток коррозии 130,86 мА. После анодирования коррозионное сопротивление возрастает до 24,216 кОм, а ток коррозии падает до 7,494 мА.
По данным коррозионных кривых можно заметить, что потенциал коррозии смещается в отрицательную область в ряду SSA, IC, BD, EC, чистый Al. В этом же ряду снижается и коррозионная стойкость алюминия.
Скорость атмосферной коррозии чистого алюминия составляет 0,4284 мм/год. После анодирования скорость коррозии снижается до 0,0817 мм/год.
Микроизображения поверхности анодированного алюминия с различными видами уплотнения и наполнения до и после коррозии приведены на рисунке 14.

Рисунок 14 — Микроизображения в режиме топографического контраста аноднооксидных покрытий: SAA - анодирование металла с уплотнением в воде; BD - с наполнением в черном органическом красителе; IC - с наполнением в неорганическом красителе; EC - с электрохимическим окрашиванием в солях олова.
Исходя из практики минимальная толщина оксидных покрытий, обеспечивающих защиту изделий, выбирается согласно условиям эксплуатации:
- в закрытых помещениях с искусственно регулируемыми климатическими условиями - 9 мкм;
- на открытом воздухе в сельской, лесной, горной местности вдали от промышленных объектов - 15 мкм;
- на открытом воздухе в городской и приморской атмосфере - 21 мкм;
- на открытом воздухе в промышленной атмосфере северного побережья (хлориды не менее 10 мг/м2 * сутки) с продолжительным увлажнением - 24 мкм;
- при нанесении лаков и красок допускается уменьшение толщины покрытия до 9 мкм при эксплуатации на открытом воздухе и до 15 мкм в морской атмосфере.
Наилучшая коррозионная стойкость отмечена для покрытий, полученных на чистом алюминии.
Добавление к алюминию меди, кремния, железа, магния, марганца улучшают механические свойства сплава, но ухудшают защитную способность получаемых оксидных покрытий. Кремний и интерметаллид Al6Mg окисляются гораздо медленнее, чем алюминий, и остаются в виде вкраплений в покрытии. Напротив, интерметаллиды Al3Mg2, Al2Cu, CuAl2, CrAl7, Co2Al9, Co2Al5,Co4Al13, Al7CuFe, Al6CuNi легко разрушаются и увеличивают пористость покрытия. Так, коррозионная стойкость покрытий толщиной 2,5-10 мкм, полученных на сплаве АД1 в 6-7 раз выше, чем покрытий на сплавах 1915 и АД31, и в 2-3 раза выше, чем покрытий на сплаве АМг2АП. Увеличение толщины покрытий до 15 мкм сглаживает эти различия.
Коррозионная стойкость оксидных покрытий повышается при увеличении толщины барьерного слоя, на долю которого приходится примерно 1/3 оказываемого сопротивления коррозии. Вместе с тем наращивание толщины пористой части покрытия благотворно сказывается на их коррозионной стойкости только в случае сравнительно тонких покрытий, тогда как дальнейшее увеличение толщины сопровождается увеличением диаметра пор и снижением защитных свойств.
|
Электролит |
Рабочая температура |
Напряжение на ванне |
Число пор на 1 м2 n*1012, шт |
|
Серная кислота (15%) |
10 |
15 20 30 |
79,1 53,1 28,4 |
|
Хромовая кислота (3%) |
29 |
20 40 60 |
22,2 8,28 4,29 |
Пористость поверхностного слоя оксида меняется от 15 до 40% в зависимости от марки сплава и режима анодирования. С увеличением температуры электролита пористость растет.
Коррозионная стойкость пленок несколько увеличивается с ростом их толщины, однако сопровождающее наращивание покрытия увеличение его пористости и образование трещин в поверхностном слое резко увеличивает скорость коррозионного поражения.
Защитная способность анодно-окисных покрытий может быть существенно улучшена операцией наполнения пор в различных растворах, содержащих вещества, замедляющие коррозию. Перспективным способом повышения коррозионной стойкости анодно-окисных покрытий следует признать создание комбинированных покрытий, в которых пористый оксид играет роль адсорбционного слоя, который удерживает органический полимерный материал, стойкий к агрессивным средам.
5.2 Физико-механические и электрофизическе свойства оксида алюминия.
Защитно-декоративные оксидные покрытия, полученные в водных растворах серной кислоты, обладают высокими значениями электрофизических характеристик. Микротвердость оксидов, полученных при плотности тока 0,5-2 А/дм2, составляет Н 300 - 500, тогда как технически чистого алюминия - около Н 30. Микротвердость анодных пленок, измеренная на микротвердомере ПМТ-3, на техническом алюминии может достигать Н 600, а на химически чистом алюминии - Н 1500. При этом микротвердость полученных покрытий неравномерна по толщине: прилегающие к металлу слои имеют микротвердость на 50-100% выше, чем наружные, что связано с большей пористостью поверхностных слоев.
Микротвердость функциональных анодно-окисных покрытий зависит от природы алюминиевого сплава и составляет (ГПа):
- на чистом алюминии - 4,9-5,1,
- на сплаве АВ - 4,7-4,9,
- на сплавах типа АЛ - 4,4-4,7,
- на сплаве Д16 - 3,24-3,53.
Наиболее качественные покрытия формируются на чистом алюминии и его сплавах с магнием, наименее качественные - на сплавах с содержанием меди свыше 4,5% (Д1, Д16, Д20)
Анодный оксид является хорошим диэлектриком: удельное сопротивление в среднем составляет 4∙1015 Ом∙см, пробивное напряжение может достигать 1 кВ и более.
Для улучшения прочностных и электроизоляционных свойств получают утолщенные покрытия (обычно 40 - 90 мкм, хотя возможно оксидирование до толщины нескольких десятых миллиметра). В некоторых отраслях промышленности (приборостроение, машиностроение, авиационная техника) толщина покрытий ограничивается 75 мкм в связи с высокой вероятностью образования трещин на толстых покрытиях и дефектностью покрытий на деталях, имеющих острые кромки, что резко снижает электроизоляционную способность и износостойкость покрытия.
На электрофизических свойствах сказываются не только толщина и пористость, но и структура покрытия, поэтому результаты сильно зависят от состава электролита и режима обработки.
Так, покрытия, полученные в сульфатном растворе с модифицирующими добавками на алюминии АД0 толщиной 84 мкм с пористостью 14% имели пробивное напряжение 2,5 кВ, тогда как покрытия толщиной 165 мкм с той же пористостью - всего 1,5 кВ.
Пленки толщиной 161 мкм при пористости 9% показали пробивное напряжение 1,83 кВ, а покрытия толщиной 154 мкм при пористости 23% - 2,33 кВ.
Пробивное напряжение на литейных сплавах ниже, чем на деформируемых.
Теплоизоляционные свойства оксидированных алюминиевых сплавов выше по сравнению с неоксидированным металлом. Теплопроводность оксида алюминия равна 0,004-0,012 Дж/(см∙с∙°С), что в 200-500 раз ниже, чем у чистого алюминия. Коэффициент теплового излучения анодированной поверхности в 10 раз выше по сравнению с чистым металлом.
Толстые пленки на алюминиевых сплавах обладают повышенной стойкостью против воздействия высоких температур, выдерживая нагрев до 2000°С. Поэтому оксидирование используют при изготовлении изложниц для разливки алюминиевых и магниевых сплавов. При длительном многократном воздействии высоких температур на оксидированной поверхности образуются микротрещины, обусловленные различием в значениях коэффициента линейного расширения анодной пленки и алюминия.
Рост оксидного слоя сопряжен с частичным растворением металла основы и поверхностного слоя образующегося оксида, что сказывается на изменении размера детали в процессе обработки. В первые полчаса обработки происходит увеличение размера оксидируемой детали на 1 - 2 мкм, но в дальнейшем начинается уменьшение размера до -2 мкм через 1 час обработки и далее. Поэтому при нанесении утолщенных покрытий необходимо учитывать изменение размера деталей в процессе нанесения покрытия. Увеличение размера детали при анодном оксидировании алюминия и его сплавов меньше, чем толщина полученного покрытия. Обычно увеличение размера детали составляет от 30 до 60% от полученной толщины оксидного слоя в различных электролитах (в среднем 50%).
6. Уплотнение и окрашивание анодных оксидных пленок на алюминии.
Значительная пористость оксидного покрытия приводит к тому, что оно легко адсорбирует влагу, различные растворы и органические вещества. Пористость при анодном оксидировании играет положительную роль как необходимый фактор для наращивания толщины оксидного слоя, однако в процессе эксплуатации незакрытые поры являются слабым местом покрытия, по которым в первую очередь будет протекать коррозионный процесс. Поэтому после формирования пористого оксида его обязательно подвергают дополнительной обработке, призванной закрыть поры - либо гидратированным оксидом алюминия (при уплотнении водой, в неорганических и органических веществах), либо различными лаками, маслами и другими веществами при соответствующей пропитке.
Способность к адсорбции органических веществ лежит в основе процесса окрашивания анодно-оксидных покрытий (рисунок 15, 16).

Рисунок 15 — Примеры анодированных алюминиевых деталей, наполненных в черном красителе.
Прозрачные и полупрозрачные защитно-декоративные покрытия алюминия и его сплавов окрашивают в водных кислотных органических красителей. Окраска пленок, полученных в различных электролитах анодирования, различается из-за разницы структуры, пористости и естественного цвета покрытий. Для получения необходимых цветов используют смеси анилиновых красителей. Кроме органических красителей применяются и неорганические. Так, ограниченную цветовую гамму, но большую светостойкость анодно-оксидных покрытий получают реакцией двойного обмена в растворах неорганических солей.

Рисунок 16 — Примеры анодированных алюминиевых деталей, наполненных в бирюзовом, фиолетовом и красном красителе.
Коррозионная стойкость алюминия и его сплавов (особенно в воде и водных средах), может быть значительно повышена уплотнением в растворе хромовых солей. Обычно используется натриевая соль ввиду экономической целесообразности. Составы для уплотнения анодно-оксидного покрытия в бихроматах регламентируются техническими условиями DEF151 и основаны на работах, первоначально выполненных в СССР и США.
Различают составы на основе бихромата натрия с карбонатом или гидроксидом натрия и на основе бихромата натрия. Обработка в первом растворе для уплотнения анодированного алюминия длится 5-10 минут. Данное время недостаточно для проведения полного уплотнения оксидной анодной пленки гидратацией, но оно обеспечивает поглощение значительного количества хроматов. Анодное покрытие окрашивается после этого в желтый цвет. Интенсивность окрашивания в желтый цвет повышается в зависимости от толщины покрытия.
Второй состав для уплотнения анодированного алюминия в бихромате без других добавок подразумевает обработку на протяжении времени, которое было потрачено на само анодирование. Этот состав обеспечивает удовлетворительную степень гидратации, но не обязательно полное уплотнение.
7. Цветные аноднооксидные покрытия.
Покрытия могут окрашиваться не только наполнением в красителях органической и неорганической природы. Они также могут получаться цветными напрямую из некоторых электролитов.
Если в этих электролитах алюминий и его сплавы анодируются вначале переменным, а затем постоянным током, то покрытия получаются окрашенными в цвет от светло-соломенного до золотистого и бронзового.
Еще одним способом окрашивания анодированного алюминия является электрохимическая обработка в солях олова или никеля.

Рисунок 17 — Примеры анодированных алюминиевых деталей
8. Анодирование с упорядоченной архитектурой микропор.
8.1 Введение в упорядоченное анодирование.
Следующим шагом эволюции процесса анодирования является анодирование с упорядоченной архитектурой микропор. По сути, это уже нанотехнологии, т.к. в процессе получаются нанопоры идеально правильной формы (рисунок 18d).
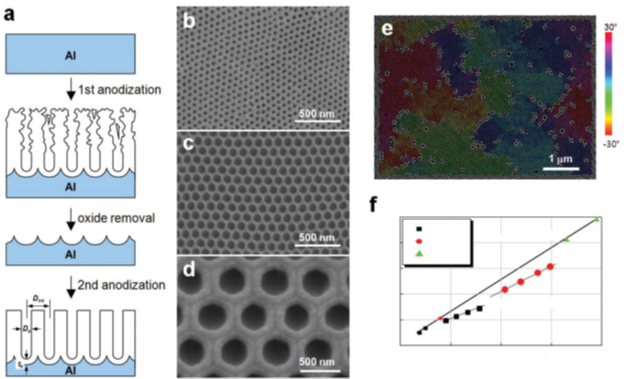
Рисунок 18 - Схематическая процедура обычного двухступенчатого мягкого анодирования (MA) для самоупорядоченного анодного оксида алюминия (AOА) b–d - Типичные SEM-микрофотографии самоупорядоченных AOА, полученных с помощью MA с использованием: b - 0,3 M H2SO4 при 25 В, c - 0,3 M H2C2O4 при 40 В и d - 1 мас.% H3PO4 при напряжении 195 В. e - СЭМ-изображение с цветовой кодировкой AOА, сформированное двухступенчатой СА с использованием 0,3 М H2SO4 при напряжении 25 В, демонстрирующее полидоменную структуру. Область с таким же цветом состоит из домена. Поры, которые не имеют видимой гексагональной координации (т. е. поры с дефектами), отмечены белым цветом. f - Сводка потенциалов самоуплотнения и соответствующего межпористого расстояния Dint при мягком анодировании (МA) и твердом анодировании (ТА).
Такие покрытия применяются сегодня в высокочувствительной сенсорной технике, биомедицинских, светочувствительных устройствах, накопителях информации и агрегатах сбора энергии.
Пористый оксид алюминия, полученный анодированием (АОА) в контролируемых электрохимических условиях, имеет значительное количество пор, не имеющих связи друг с другом. Эти циллиндрические поры проходят к границе раздела фаз оксид/металл. Каждая нанопора прикрыта тонким полусферическим барьерным слоем. В целом это и есть та самая гексагональная ячейка, в реальности редко имеющая столь правильный вид при традиционном анодировании алюминия.
Ячейки далее самоорганизуются в соты (гексагональнаяя плотноупакованная структура). Самоупорядоченные нанопористые аноднооксидные покрытия могут быть получены с однородным диаметром пор 20–400 нм и плотностью 108-1010 пор/см2.
Изначально считалось, что для нанопористого архитектурного анодирования подходят только мягкие покрытия - в режиме твердого анодирования образуются микротрещинные, неоднородные по структуре пленки.
8.2 Получение нанопористых АОА в варианте мягкого анодирования.
Впервые информация о возможности упорядоченного анодирования была получена в 1995 году. При анодировании алюминия в специальном электролите на протяжении 160 часов в потенциостатических условиях Масуда и Фукуда обнаружили, что пленки демонстрировали автономную конфигурацию клеток в нижней части покрытия.
Имела место перестройка изначально неупорядоченного слоя, причем, размер идеализированной зоны увеличивался со временем анодирования, но не превышал нескольких микрометров.
В дальнейшем развитие процесса привело к двухэтапному анодировнаию (рисунок)
Экспериментальные наблюдения привели к развитию процесса «двухэтапного анодирования», с помощью которого можно получить нанопористые АОА с высокоупорядоченным расположением однородных нанопор (рисунок 18 а).
Многие исследования показали, что структурные параметры АОА:
- Dp - диаметр пор.
- Dint - межпористое расстояние.
- tb - толщина барьерного слоя.
сформированных в режимах самоупорядочения, зависят в первую очередь от напряжения на ванне U (точнее – потенциала анода).
Упорядоченные AOА наносятся в ограниченном технологическом окне, известном как «режим самоупорядочения». В нем идет самоорганизованный рост упорядоченных нанопор (рисунок 18 (b–d)):
- серная кислота (H2SO4) при 25 В для расстояния между отверстиями Dint = 63 нм
- щавелевая кислота (H2C2O4) при 40 В для Dint = 100 нм
- фосфорная кислота (H3PO4) при 195 В для Dint= 500 нм.
Dint и tb линейно зависят от U с константами пропорциональности ζ = 2,5 нм*В–1 для Dint и η = 1,2 нм*В–1 для tb (рисунок 18 f). Потенциальная зависимость Dp не так чувствительна, как взаимодействие между плотностью тока и температурой, концентрацией и природой используемого электролита.
Nielschetal эмпирически установил, что для самоупорядочения АОА требуется пористость P=10% независимо от U, состава электролита и условий анодирования. P вычисляется как отношение площади поверхности пор к площади покрытия. P = (π/2*31/2) (Dp/Dint) 2 * 100.
Считается, что стационарно растущие нанопористые пленки образуются при поддержании динамического равновесия между скоростью полевого растворения оксида на границе электролит/оксид и скоростью образования оксида на границе раздела металл/оксид. Данный режим поддерживает постоянную толщину барьерного слоя.
Получение АОА с нанопорами возможно в режиме самоорганизации. Структура такого оксида, полученного в двухступенчатом процессе, имеет полидоменную структуру. Это означает наличие идеальных доменов, разделенных границей дефектных пор. Однодоменная конфигурация АОА на площади в несколько мм2 впервые была продемонстрирована Masudaetal. При этом использовалось анодирование алюминия с предварительно нанесенным рисунком. В этом процессе идет первичное (до анодирования) текстурирование поверхности наноиндентированием штампом (см. рисунок 19).
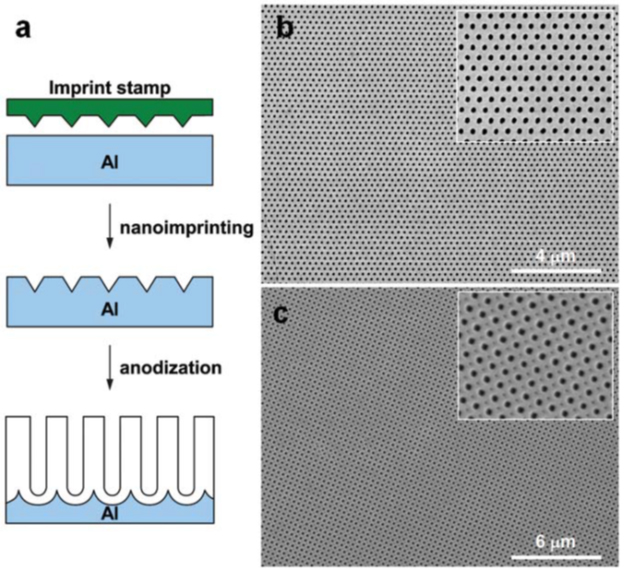
Рисунок 19 - Схема изготовления идеально упорядоченного АОА с использованием штампа.
а – этапы процесса; b,c - типичные SEM-микрофотографии дальноупорядоченного АОА с: (b) - гексагональным и (c) - квадратным расположением нанопор.
Каждый отпечаток штампа инициирует зарождение пор и приводит к упорядоченной их локализации. В дополнение к круглым отверстиям метод позволяет получать иные формы: квадратные и треугольные, в плотно упакованном квадратном или гексагональном расположении. Вместо штампа некоторым ученым удалось использовать сфокусированный ионный пучок (FIB), голографическую литографию и литографию микросфер. Была продемонстрирована возможность произвольного изменения межпорового расстояния Dint.
Предварительное штампование способствовало получению однодоменных покрытий, однако оставалось важное ограничение. Реализуемое максимальное соотношение сторон или глубина наноканалов, поддерживающих исходную конфигурацию отверстий, критически зависело от условий анодирования. Высокое соотношение сторон однородных нанопор может быть получено только в узком окне обработки (режим самоупорядочения), который практически ограничивает диапазон выбора по межпористому расстоянию: Dint = 63 нм для анодирования в H2SO4 при 25 В, 100 нм при 40 В в H2CO4 и 500 нм при 195 В в H3PO4 соответственно. Вне режима самоупорядочения резко снижается начальная степень пространственного упорядочения, определяемая наноиндентированием.
Каковы пути обхода данного ограничения? Сегодня ведутся как работы по настройке кислотных электролитов на основе H2SO4, H2CO4 и H3PO4), так и поиск новых систем. Вариации напряжения выше оптимума стабилизации процесса всегда приводят к «пробою» оксидной пленки за счет сочетания большого тока и выделяемого при его прохождении тепла.
8.3 Получение нанопористых АОА в варианте твердого анодирования.
Относительно недавно Ли с соавторами опровергли теорию о невозможности получения наноупорядоченных анодных пленок в режиме твердого анодирования. Сам процесс обычного твердого анодирования был разработан в начале 1960-х годов и отличался высокой скоростью - 50–100 мкм/ч. Его применение в нанотехнологичном анодировании было ограничено Однако этот процесс не использовался в текущих нанотехнологических исследованиях из-за трудностей, связанных с контролем важных структурных параметров, таких как Dp, Dint и соотношение сторон нанопор. Решение было найдено Leeetal за счет предварительного защитного анодирования перед твердым. В дополнение к этому потребовался точный контроль температуры. В результате удалось подавить “горение” и вырастить самоупорядоченные AOА в щавелевокислом электролите при U>100 В. Был установлен новый режим самоупорядочения с широко настраиваемым межпоровым расстоянием Dint = 200–300 нм (рисунок 16 f). Скорость роста оксида, ожидаемо, была выше в 25-35 раз, по сравнению с процессмо мягкого анодирования. Далее были получены аналогичные данные в других электролитах. В щавелевокислом электролите пористость PТA оказалась 3,3-3,4%, что было на треть меньше рекомендуемых значений для самоупорядочения покрытия (10%) в режиме мягкого анодирования.
Leeetal пошел дальше и реализовал получчение мембран с периодически модулируемым диаметром нанопор вдоль осей пор путем комбинации мягкого и твердого анодирования с соответствующей заменой раствора (рисунок 18 a). Совсем недавно они дополнительно показали, что AOА испытывающие спонтанные колебания тока с амплитудой 0,8 A/см2 в потенциостатическом режиме, могут иметь модулированные поровые структуры, в которых контраст модуляции пропорционален амплитуде колебаний тока. Они допустили преднамеренное манипулирование током во время анодирования алюминия (рисунок 20b).
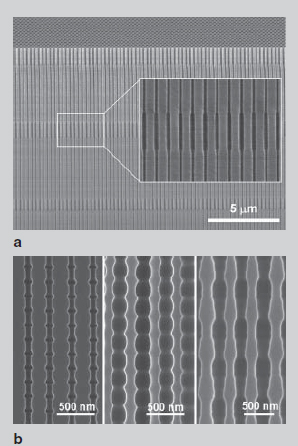
Рисунок 20 - СЭМ-микроизображение:
а - поперечное сечение AOА, полученного комбинацией мягкого анодирования и жесткого анодирования; b – поперечное сечение АОА, испытавших спонтанные колебания тока во время жесткого анодирования. Профили осциллирующего тока определяют геометрию нвнутренних пор нанопористой АОА.
Изготовленные АОА с модулированной структурой пор могут быть исходными материалами для разработки 3D-пористых архитектур для:
- Фоточувствительных устройств,
- Модельных систем для исследования разделения частиц и адсорбционных характеристик молекул.
- Шаблонных материалов в изготовлении нанопроволок или нанотрубок, диаметры которых периодически модулируются вдоль их осей, и, таким образом, позволяют изучать различные физические свойства, обусловленные топографией поверхности.
8.4 Импульсное анодирование.
Комбинация режимов мягкого (низкий потенциал) и твердого (высокий потенциал) анодирования позволяет применить уникальный процесс непрерывной структурной инженерии нанопористых АОА, основанный на импульсном анодировании алюминия в потенциостатических условиях с использованием H2SO4 или H2C2O4 (рисунок 21 a).
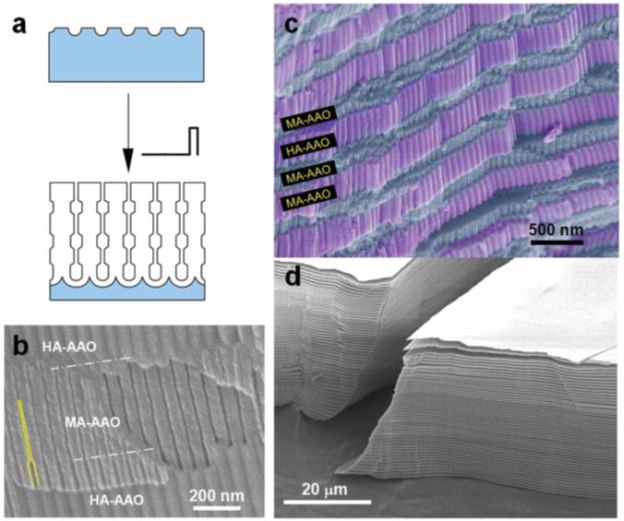
Рисунок 21 – а - Схема изготовления AAO с модулированным диаметром пор путем импульсного анодирования; b,c - SEM-изображения, показывающие вид в поперечном сечении свежеприготовленного AOА, образованного импульсным анодированием H2SO4; d - СЭМ-изображение стопки нанопористых мембран AOА. Все пластины сегментов MA-AOА были отслоены от предварительно приготовленного AOА путем селективного удаления сегментов ТA-AOА с использованием H3PO4.
Во время процесса плотность тока периодически изменяется до значения, соответствующего каждому импульсному потенциалу: iMA для UMA и iТA для UТA, причем iMA<iТA). Таким образом, поровая структура полученного AOА периодически модулируется (рисунок 21 b).
Нанопористые АОА, образованные в процессе ИA, демонстрируют слоистую структуру из MA-AOА с меньшим диаметром пор и ТA-AOА с большим диаметром пор, в которых толщина каждого анодированного сегмента определяется длительностью импульса (τMA и τТA) при заданных потенциалах анодирования UMA и UТA (рисунок 21 c).
При импульсном анодировании из серной кислоты часть покрытия, образованная импульсом высокого напряжения, включает в себя больше анионных примесей, по сравнению с участком низкого напряжения. Соответственно, импульсный режим приводит к периодической модуляции состава покрытия вдоль осей пор. Сегменты с более высоким содержанием примесей менее коррозионностойки, например, в 5% H3PO4. Потому применение далее такого травителя позволяет полностью расслаивать стопку на отдельные мембраны (рисунок 21 d), формируя экономичный и непрерывный способ их производства.
Важным преимуществом импульсного наноструктурного анодирования является тот факт, что чередование режимов способствует лучшему рассеиванию тепла с поверхности заготовок. Анодирование алюминия экзотермично, а химическое растворение оксида электролитом – эндотермично. Основной разогрев анода связан с прохождением тока через барьерный слой. Тепловыделение при этом можно рассчитать:
Q = Uit = Rbi2t
где:
i – плотность тока.
Rb – сопротивление барьерного слоя.
t – время реакции.
Соответственно, твердое анодирование порождает много тепла из-за высокой плотности тока, примерно на 2-4 порядка, чем при мягком анодировании. Избыточное тепло разрушает оксидную пленку, искажает ее структуру. Но, в импульсном режиме накопленное тепло во время импульса твердого анодирования может эффективно рассеиваться во время последующего импульса мягкого анодирования. Таким образом, прогорание оксидной пленки преодолевается.
8.5 Примеры формирования матричнопленочных хемочувствительных гетероструктур с использованием технологии сквозного анодирования Al.
Технология сквозного самоупорядоченного анодирования применяется при производстве сенсоров, в частности, хемочувствительных к определенным газам. Основой сенсора при этом выступает кремниевая пластина КЭФ-4,5 (10), на которую наносится субмикронный слой алюминия напылением, который далее анодируется и покрывается оксидами титана, олова, вольфрама, молибдена или цинка.
Для двухстадийного сквозного анодирования можно использовать 0,3-0,5М раствор малоновой кислоты в потенциостатическом режиме. В результате можно получить ячеисто-пористую структуру с диаметром пор 100-200 нм и средним размером ячейки − 500 нм, что благоприятствует конформному нанесению функциональных хемочувствительных покрытий. При использовании щавелевой кислоты поры получаются меньшего диаметра, винной – большего (рисунок 22)

Рисунок 22 – Микроскопические изображения поверхности пленок анодного оксида алюминия, сформированных в растворах щавелевой (а), малоновой (б) или винной (в) кислоты.
Для нанесения функциональной пленки оксида на анодированную матрицу применяются химические и электрохимические технологии: методы осаждения из пленкообразующих растворов или золей, молекулярного и ионного наслаивания, электроосаждения, электрофоретического нанесения из золей, ультразвукового осаждения.
Например, для формировнаия слоя SnxZnyOz вначале проводится электрохимическое окисление
Sn2+→Sn4+
в 1% растворе SnSO4 на поверхности пористой структуры анодированной пленки с осаждением гидроксидов олова (IV) в порах. Затем идет дегидратационный отжиг. На второй стадии идет химическое осаждение гидроксида цинка на поверхности сформированного оксида олова (IV) за счет обработки в 0,01 М растворе ZnSO4 и 1% растворе КОН. В конце производится отжиг при 750° С в течение 30 мин.
При нанесении TiO2 на пористую матрицу электрофоретическим осаждением можно получить пленки островкового типа с блочной структурой. Эти же пленки, полученные методом наслаивания характеризуются повышенной однородностью модификации профилированной поверхности по сравнению со способом обработки в пленкообразующих растворах с ультразвуком.
Метод ионного наслаивания позволяет получать пленки, наиболее равномерно заполняющие оксидную анодную матрицу. Слой характеризуется сплошной структурой Si/Al2O3/SnxMoyOz и Si/Al2O3/SnxWyOz (рисунок 23).

Рисунок 23 – Микроскопические изображения поверхности структур n-Si/Al2O3/TiO2 (а), n-Si/Al2O3/SnxMoyOz (б) и n-Si/Al2O3/SnxWyOz (в), сформированных методом химического осаждения (а) или ионного наслаивания (б, в)
8.6 Получение нанопроволок из меди с применением матриц из наноструктурированного анодированного алюминия.
Новым витком развития современной прикладной электрохимии стало получение наноразмерных объектов, например:
- нанокомпозиты из металла и полупроводников.
- пленки из оксида меди.
- микропровода, в т.ч. многослойные из никеля с высоким магнетосопротивлением, применяемые в качестве инфракрасных поляризаторов.
- сверхрешетки, на которых наблюдаются различные квантовые оптические, электронные и оптоэлектронные эффекты.
- сверхпроводящие нанопроволоки.
Указанные материалы получают также для изучения магнитных полей в слоистых структурах, измерения сопротивления при низких температурах, изучения магнетосопротивления.
Получение медных нанопроволок производится различными методами:
- Литографический. В слое SiO2 приготавливаются канаки, в которые осаждается медь.
- Термическое осаждение медных дорожек.
- Электроосаждение в мембраны: полимерные и из наноструктурированного анодированного алюминия (АОА).
Полимерные мембраны получаются бомбардировкой исходного материала фрагментами деления ядер. При этом образуются треки от 6 до 20 нм. Затем они травятся до образования пор.
Пористые АОА-мембраны готовят анодированием металлического алюминия в кислом растворе, как описывалось выше. Мембраны должны содержать гексагональную сетку цилиндрических строго вертикальных пор (в отличие от наклонных в полимерных мембранах). После анодирования в мембране не остается чистого алюминия, поэтому токоподвод создается напылением металла на одну из сторон мембраны.
Типичный транзиент тока при потенциостатическом электроосаждении металла в матрицу представлен на рисунке 24.
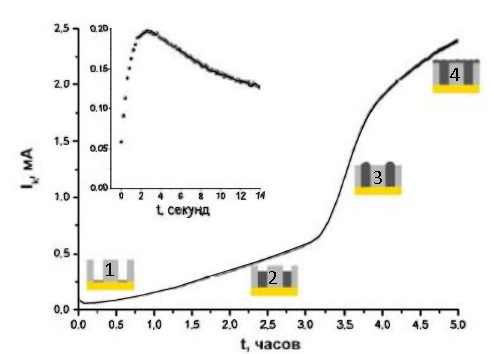
Рисунок 24 - Зависимость тока от времени при потенциостатическом осаждении Cu в АОА-матрицу.
Кривая содержит 4 участка:
- Первый соответствует зародышеобразованию - кривая “ток-время” имеет максимум. Для описания участка применяется модель Шарифкера и Хиллса при диффузионном контроле.
- Второй - рост проволок в порах. По мере приближения фронта роста металла к наружной поверхности мембраны уменьшаются диффузионные ограничения и увеличивается допустимая плотность тока. На длину участка влияет скоростью роста металла и глубина пор.
- Третий – выход отдельных проволок на поверхность, сопровождающийся увеличением суммарной площади катода. При этом наблюдается резкий скачок тока на кривой.
- Четвертый – зарастание металлом всей мембраны. Рост тока почти или совсем прекращается
Матрицы из анодированного алюминия могут использоваться не только для получения чистых металлов, но и для выращивания биметаллов, например, медь-никель – системы, характеризующейся сходными ГЦК-решетками компонентов с близкими параметрами и сочетанием ферромагнетизма никеля с парамагнетизмом меди.
Для получения чередующихся слоев ферромагнетика и парамагнетика существует 2 технологии с применением АОА-матриц:
- Single bath – традиционное электроосаждение с многократной заменой электролита. Возможно применение вращающегося катода, при этом минимальная толщина одного слоя может соответствовать 19 ангстрем.
- Dual bath – электроосаждение с применением одной ванны, содержащей ионы обоих металлов, причем концентрация меди в ней на два порядка меньше. Управление составом осаждаемого металла производится изменением потенциала. Ферромагнитный слой при этом формируется сплавом никель-медь.
Загрязнение образцов в single-bath равно 15 %, dual-bath - 1%.
Далее можно сравнить результаты получения нанопроволок с применением полимерных и АОА-мембран, проведенных в исследованиях Цирлиной Г.А. и Оразбаевой А.Н.
Применяемые в исследовании полимерные мембраны фирмы Whatman двух типов были изготовлены из поликарбоната, описание их параметров после уточнения электронной микроскопией приведено в таблице ниже:
| Номинальный диаметр пор мембраны, нм | Толщина мембраны, μм | Площаль пор,μм2 | Диаметр, нм | Плотность пор,μм-2 | Масса осажденной меди при полном заполнении пор, μг | Расчетный заряд, Кл |
| 100 (Мп) | 12,3±0,1 | 0,007±0,002 | 100±20 | 5,35 | 80,4±16,1 | 0,3±0,1 |
| 600 (Бп) | 7,9±0,1 | 0,2±0,05 | 450±20 | 0,35 | 96,6±19,3 | 0,3±0,1 |
Изображения 25 и 26 получены для мембран после термического вакуумного напыления на их противоположную сторону золота. Для исключения деформации полимера напыление велось слоями, не более 50 нм каждый.

Рисунок 25 - SEM изображение полимерной мембраны с номинальным диаметром пор 600нм.

Рисунок 26 - SEM изображение полимерной мембраны с номинальным диаметром пор 100нм.
Аналогично, параметры АОА-мембраны, приведены в таблице ниже:
| Напрядение анодирования, В | Электролит, используемый для получения оксидной мембраны | Dint Расстояние между порами, нм | Dp Диаметр пор, нм | P Пористость, % | Масса осажденной меди при полном заполнении пор (толщина мембраны 10 мкм), μг | Расчетный заряд, Кл |
| 120 | 0,3М (COOH)2 | 240 | 120-160 | 23-40 | 400-720 | 1,2-2,1 |
| 40 | 0,3М (COOH)2 | 105 | 40-70 | 13-40 | 230-720 | 0,7-2,1 |
Их микроизображения - на рисунках 27, 28.
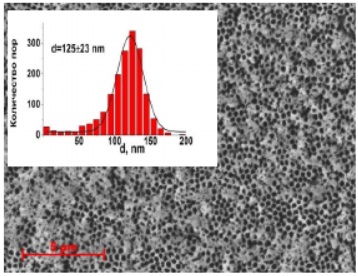
Рисунок 27 - SEM изображение оксидно-алюминиевой мембраны (напряжение анодирования 120В)
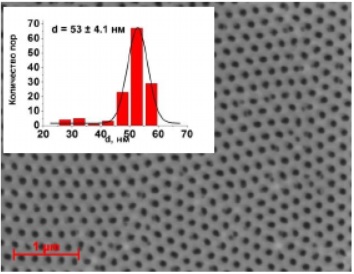
Рисунок 28 - SEM изображение оксидно-алюминиевой мембраны (напряжение анодирования 40В)
Золото толщиной 250 нм на мембрану напылялось магнетронным способом.
Оксидные мембраны первоначально имеют закрытые поры, удаление донышек производится путем химического травления. Если перетравить - то они будут неровными, что приведет к невозможности качественного напыления токоподвода.
Осаждение меди во всех случаях велось из сульфатного электролита в специальной ячейке.
Ниже приводятся транзиенты тока при осаждении медных нанопроволок в полимерные (БП-600нм) и АОА-мембраны (рисунок 29, 30).
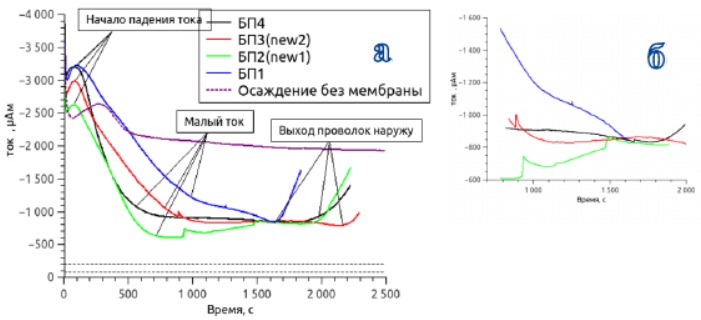
Рисунок 29 - Транзиенты тока при осаждении в полимерную мембрану с порами 600нм. а - представлен процесс осаждения до момента выхода впроволок наружу б - более подробно показано осаждение при малых токах
Большие значения тока на начальных участках транзиента соответствовали росту меди под мембранами - из-за неполного покрытия золотом пор электролит просачивался под мембрану.
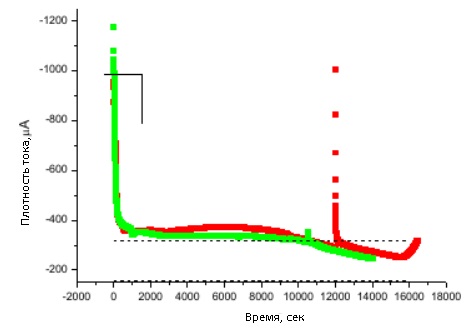
Рисунок 30 - Зависимость плотности тока от времени при потенциостатическом осаждении меди в матрицу A-15 Al2O3
На рисунке 30 видно резкое уменьшение тока, что соответствует росту проволок в порах.
Пунктирные линии на рисунках указывают диапазон токов осаждения в мембраны, с учетом погрешности, в предположении, что он пропорционален току при осаждении на гладкую подложку без мембраны с учетом ее пористости.
Извлечение проволок – отдельная технология. Для полимерных матриц это многократное растворение в дихлорэтане с последующей обработкой ультразвуком (рисунок 31, 32). Для АОА-матриц - растворение в 3M NaOH, затем - в изопропиловом спирте с дальнейшей обработкой ультразвуком (рисунок 33).

Рисунок 31 - SEM изображения полимерных мембран с уже осажденными проволоками на поперечном срезе

Рисунок 32 - SEM изображения полимерных проволок, полученных из полимерных мембран
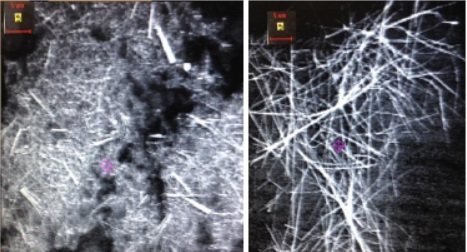
Рисунок 33 - SEM изображения проволок, полученных из оксидно-алюминиевых мембран
Если извлечение проволоки из АОА мембран проводить недостаточно долго, то она получается слипшейся. Для полного растворения требуется до 4 часов.
Недостатками методов можно выделить:
- Полимерные мембраны легче растворяются, но на них невозможно обеспечить сплошность слоя металла. Рост его под мембраной не позволяет контролировать количество металла в проволоках по пропущенному заряду. Соответственно, суспензия проволок оказывается загрязнена фрагментами осадка под мембраной.
- Для оксидных мембран требуется усовершенствование методики растворения матрицы.

Читайте также статьи
Перечень видов анодировки
Ассортимент оксидных покрытий в различные цвета
Анодирование радиаторов
Что такое радиатор, где используется и для чего анодируется?
Заказать анодирование (Ан.окс)
Сделать заказ анодного оксидирования (анодировка) на заводе с сертификатом

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



