

Механизм и технология получения покрытий рением из расплавленных электролитов. Структура и свойства рения.
Содержание:
3. Методы осаждения рениевых покрытий.
1. Что такое рений?
Рений — рассеянный тугоплавкий металл серебристо-серого цвета, с гексагональной плотноупакованной кристаллической решеткой, имеющей параметры а = 0,2760 нм, с = 0,44580 нм, z = 2. Температура плавления рения составляет 3180° С, по тугоплавкости он уступает лишь вольфраму.
Рений пластичен в литом и рекристаллизованном состоянии, деформируется на холоду, имеет исключительно высокое сопротивление деформации. При температурах до 2000° С рений сохраняет высокие прочностные и пластические характеристики, опережая другие тугоплавкие металлы. Рений обладает высокой коррозионной стойкостью во влажных средах, не растворяется при комнатной температуре в растворах соляной, серной и плавиковой кислоты. Рений устойчив в атмосфере водорода, азота и углеводородов даже при высоких температурах. Данные характеристики рения и определили его применение в мировой промышленности, а именно как материал для:
- жаропрочных сплавов на основе W - Мо, а также сплавов на основе Ni, Cr, Mo, Ti;
- электрических контактов;
- покрытий;
- термопар Pt-Re, Mo-Re, W-Re;
- рентгеновских трубок;
- вакуумных ламп;
- ламп-вспышек;
- измерительной аппаратуры;
- тиглей и ампул.
Рений также используется в:
- атомных реакторах, использующих натрий в качестве теплоносителя.
- приборах масс-спектроскопии.
- ракетных двигателях.
На реакции β-распада 187Re основан рений-осмиевый метод определения возраста горных пород и метеоритов.
Около 65% производимого в мире рения идет на получение Pt-Re катализаторов для нефтеперерабатывающей промышленности (получение бензина с высоким октановым числом).
В то же время, высокая стоимость рения, высокая температура плавления, большая чувствительность к кислороду и большая степень наклепа затрудняют общепринятые металлургические переделы и механическую обработку рения. Поэтому перспективными являются методы, позволяющие получать рениевые покрытия или готовые изделия без последующей или с минимальной механической обработкой.
Существуют различные методы получения рениевых покрытий:
- Газотермический метод (плазменное напыление);
- Вакуумное напыление;
- Газофазное напыление;
- Диффузионные методы;
- Электрохимическое восстановление из водных электролитов и из расплавов.
Электрохимическое осаждение из расплавленных солей — один из наиболее перспективных на сегодняшний день методов получения сплошных осадков и готовых изделий из рения.
Метод получения рения из хлоридных расплавов был впервые разработан в ИВТЭ УрО РАН. Он позволяет получать сплошные слои рения толщиной от нескольких микрон до нескольких миллиметров, а также фольги и изделия сложной конфигурации, годные к применению без последующей или с минимальной механической обработкой.
На структуру и морфологию рения, электроосажденного из хлоридного расплава, оказывает влияние ряд факторов:
- температура;
- плотность тока;
- катионный состав электролита;
- наличие примесей;
- материал подложки.
Важным фактором является наличие кислородсодержащих соединений в составе расплавленного электролита.
Даже небольшие примеси кислорода в составе расплавленного электролита для осаждения тугоплавких металлов оказывают существенное влияние на структуру и физико-химические свойства катодных осадков. В большинстве случаев наблюдается изменение текстуры осадков и нарушение сплошности покрытия. Однако имеются сведения для процессов осаждения вольфрама, проведенных Молчановым А.М., о том, что при определенном мольном отношении О/Me возможно получение качественных сплошных осадков со столбчатой структурой. Поэтому изучение влияния кислородсодержащих примесей на структуру и морфологию электролитических осадков тугоплавких металлов является актуальной научной задачей.
2. Свойства рения.
2.1 Физико-химические свойства металлического рения.
Некоторые химические свойства рения:
- Для рения известны соединения со степенью окисления от +7 до -1.
- Образование оксидов рения ReO2, Re2O7 на воздухе, начинается при 300° С и интенсивно протекает выше 600° С.
- Металлический рений реагирует с горячей серной кислотой, хорошо растворяется в азотной кислоте, а также перекиси водорода, с образованием рениевой кислоты, довольно легко растворяется в бромной воде при слабом нагревании.
- С фтором при нагреве рений образует смесь ReF5, ReF6 и ReF7, с Cl2 - ReCl4 и ReCl5, с Br2 - ReBr5, с I2 не реагирует.
- Взаимодействием порошков рения и графита при 1000°С и давлении 920 кПа получен карбид ReC.
- С растворами щелочей рений реагирует медленно, с расплавами быстро (особенно в присутствии окислителей), давая перренаты MeReO4.
- При восстановлении аммиаком NH4ReO4 или ReCl3 при 300-350° С получен нитрид ReN0,43. Он разлагается при 280° С в вакууме.
- С фосфором выше 750-800° С рений образует фосфиды, с мышьяком - арсениды, с кремнием при спекании - силициды, с серой - ряд сульфидов (эффективные катализаторы гидрирования органических веществ).
2.2 Свойства оксидов рения.
Рений интересен тем, что образует достаточно большой ряд оксидов: ReO4 (Re2O8), Re2O7, ReO3, Re2O5, ReO2, Re2O3, ReO (Re2O2) и Re2O, характеризующиеся различной устойчивостью. Высшие оксиды имеют кислый характер, низшие - основный.
Диоксид рения ReO2 образуется:
• при частичном восстановлении высших оксидов рения водородом при 300° С,
• при длительном нагревании рения с Re2O7 при 600 - 650° С:
3Re + 2Re2O7 = 7ReO2
• при нагревании ReO3 до 300 °С в вакууме:
4ReO3 = 2ReO2 + Re2O7 + 0,5O2
• при диспропорционировании соединений Re (VI):
3Re (VI) -> Re(IV) + 2Re (VII)
Триоксид рения ReO3 образуется по реакциям:
3Re2O7 + Re = 7ReO3
Re2O7 + ReO2 = ReO3
ReO3 разлагается при нагревании под вакуумом до 400° С, на воздухе -при температуре 110° С.
Пентаоксид рения Re2O5 получен при действии на раствор Re (VII) в концентрированной серной кислоте сульфата железа (II). Пентаоксид рения также образуется электрохимическим восстановлением перрената в сернокислом растворе.
Семиоксид рения Re2O7 — высший и наиболее устойчивый оксид рения, образуется при обработке металлического рения избытком кислорода при температуре выше 150°С. Re2O7 представляет собой желтые кристаллы с температурой плавления 300°С.
Re2O7 может образовываться по реакции при 750 °С:
7ReO2 = 2Re2O7 + 3Re
При сплавлении ReO2 со щелочами на воздухе образуется перренат KReO4, в атмосфере азота - ренат K2ReO3, в вакууме - ренит K2ReO4.
2.3 Химические свойства галогенидов и оксогалогенидов рения.
В литературе описаны фториды и оксофториды рения: ReF7, ReF6, ReF5 ReO3F, ReOF5, ReO2F3, ReOF4, ReO2F2. Все фториды и оксофториды рения легко возгоняются при низких температурах и легко гидролизуются водой. Рений - единственный металл, образующий устойчивый гептафторид ReF7.
С бромом рений образует бромиды и оксобромиды: ReBr5, ReBr4, Re3Br9, ReO3Br, ReOBr4.
С йодом рений дает соединения: ReJ4, Re3J9, ReJ2, ReJ, и не образует оксойодидов.
Известны хлориды и оксохлориды рения: ReCl6, ReCl5, ReCl4, Re3Cl9, ReO3Cl, ReOCl4. Из хлоридов рения наиболее изучены ReCl5 и ReCl3. Для высшей степени окисления рения (+7) известен только оксохлорид ReO3Cl, который образуется по реакции:
2ReO3 + Cl2 -> 2ReO3Cl
Высший хлорид рения имеет степень окисления +6. Он образует в присутствии следов кислорода - ReOCl4, а в атмосфере кислорода - ReO3Cl.
Высший оксохлорид рения (VI) образуется по реакциям:
6ReCl3 + 5O2 = 4ReOCl4 + 2ReO3Cl (в токе сухого кислорода)
ReCl5 + 0,5O2 = ReOCl4 + 0,5Cl (на воздухе)
Оксохлорид рения (VI) реагирует с водой:
3ReOCl4 + 7H2O = 2HReO4 + ReO2 + 12HCl
Re (V) образует пентахлорид ReCl5 при действии избытка хлора на металлический рений при температуре 500-700 °С:
Re + 2,5Cl2 = ReCl5 (газ)
ReCl5 на воздухе образует:
16ReCl5+14O2 = 10ReOCl4 + 6ReO3Cl + 17Cl2
В воде пентахлорид рения диспропорционирует на Re (IV) и Re (VII), в атмосфере инертного газа выше 600° С диссоциирует на Re и Сl2, при 190-360° С — на Сl2 и ReCl3. При нагревании реагирует с О2 со вспышкой, образуя оксохлориды.
Тетрахлорид рения ReCl4 — легко гидролизующееся соединение. Небольшое нагревание его в вакууме ведет к образованию ReCl6, конечным продуктом разложения при 400° С является металлический рений.
Трихлорид рения получается разложением ReCl5 при 375° С в токе азота. Трихлорид рения состоит из трехядерных групп Re3Cl9, соединенных мостиками из атомов хлора. Re3Cl9 поглощает пары воды из воздуха с образованием Re(OH)Cl2. Он быстро гидролизуется водой до HF и HReO4.
Трихлорид ReCl3 при 400-450° С сублимируется с разложением, при 800-850° С испаряется без разложения, выше 1000° С диссоциирует на Re и Сl2, на воздухе при комнатной температуре устойчив, в присутствии влаги образует дигидрат ReCl3*2H2O, при нагревании на воздухе или в среде О2 дает оксохлориды и Сl2
Все галогениды рения могут быть разложены до металла при повышенных температурах. Термодинамическая устойчивость галогенидных комплексов рения уменьшается при переходе от J- к Cl-.
При сплавлении ReCl5 с хлоридом щелочного металла образуется гексахлорренат.
Известны оксихлоридные комплексы ReOCl62-, ReOCl52-. Последний легко гидролизуется во влажном воздухе до гидроксида рения (V), а затем в ReO2*H2O вследствие диспропорционирования по схеме:
3Re (V) = 2Re(IV) + Re (VII)
Кроме описанных выше хлоридов и оксохлоридов рений, по данным атласа рентгеноспектров JCPDS - internstional Centre for Diffraction Data PCPDFWIN v.2.2, 2001, образует еще Cs3Re3Cl12, Cs3Re2OCl10 и Cs2ReO3Cl3.
3. Методы осаждения рениевых покрытий.
Осадки рения возможно получать плазменным напылением порошков, вакуумной конденсацией паров металла на охлаждаемой поверхности, газофазным методом восстановления или разложения летучих соединений рения, диффузионным методом, гальваническим осаждением из водных растворов или расплавов солей.
Плазменное напыление может быть осуществлено с большой скоростью, однако получаемые при этом изотропно структурные слои имеют значительную пористость и в условиях повышенных температур, за счет конденсационно-рекристаллизационных процессов в изделиях изменяется объем слоя, возникают дефекты, приводящие к изменению свойств изделий вплоть до их разрушения.
Вакуумная конденсация позволяет получить слои высокой плотности, но, как правило, при этом малы скорости осаждения, требуется сложное оборудование и в целом технология получения толстых осадков из тугоплавких металлов, особенно при больших габаритных размерах и сложных профилях поверхности изделий, трудноосуществима.
Газофазный метод обеспечивает относительно высокие скорости наращивания неплотных слоев, обладающих требуемой кристаллографической структурой. Технология относительно проста по используемому оборудованию, но требует строгого соблюдения и контроля условий процесса, применения высокочистых компонентов, тщательного соблюдения техники взрывобезопасности.
Диффузионный метод позволяет получать тонкие покрытия, но не позволяет получать готовые изделия.
Рений возможно получать из сульфатных, сульфатно-аммонийных, фторидных, щелочных, фторидно-щелочных, оксалатных и фосфатных водных электролитов.
Водные электролиты для осаждения рения имеют следующие недостатки:
1) Используются нерастворимые аноды, поэтому состав электролита постоянно изменяется и требует частой корректировки;
2) Низкий катодный выход по току;
3) Сильное выделение водорода;
4) Осадки сильно загрязняются различными примесями, вследствие чего они, как правило, становятся твердыми, напряженными, иногда растрескивающимися. Это приводит к невозможности получения толстых компактных осадков в одну стадию электролиза.
Поэтому для получения толстых покрытий рением применяют послойное наращивание с термообработкой каждого слоя в атмосфере водорода, аргона или в вакууме при температурах 700-1100° С в зависимости от материала подложки.
Наиболее перспективным методом для получения сплошных осадков рения является метод высокотемпературной гальванопластики. Он позволяет с высокой скоростью получить сплошные чистые слои металла с точно заданной толщиной (от нескольких микрометров до нескольких миллиметров) и структурой. Так, в УрО РАН ИВТЭ были получены электролизом хлоридного расплава готовые изделия и ориентированные фольги из рения.
В литературе имеются сведения об осаждении рения из вольфраматных, хлоридно-фторидных, оксофторидных, и хлоридных расплавов.
3.1 Электроосаждение рения из вольфраматного электролита.
При осаждении рения из вольфраматных электролитов с добавками перренатов возможно получать сплошные осадки металлического рения. В работе академика Барабошкина А.Н. с соавторами были проведены кинетические исследования в расплаве Na2WO4-KReO4 с добавкой WO3, позволяющей изменять в широких пределах активность кислорода. Эксперименты проводили в алундовом тигле на воздухе, рабочим и вспомогательным электродом служил электролитический рений. В качестве электрода сравнения использовался платиново-кислородный (воздушный) электрод.
В работе были сняты катодные поляризационные кривые рения в вольфраматном электролите при различных концентрация WO3. Было замечено, что добавки оксида вольфрама (VI) сдвигают потенциал рения в положительную сторону и увеличивают предельные токи восстановления перренат-иона до металлического рения; измерены коэффициенты диффузии перренат-ионов при содержании оксида вольфрама 2 и 20% (VI) - соответственно 5,1 и 4,4 * 10-5 см2/с.
Была также предложена катодная брутто-реакция восстановления рения:
ReO4- +7e+4W2O72- = Re+8WO42-
и установлено, что при осаждении рения из вольфраматного расплава на серебряную подложку вольфрам включается в покрытие до 1%. Микротвердость осадков составляет 950-1200 кг/мм2, что выше, чем у чистого рения (274-300 кг/мм2 ) при 20°С.
В работе Тарасовой К.П. с соавторами рений осаждался из Na2WO4-K2WO4 вольфраматного электролита с добавкой оксида вольфрама (VI) и перрената калия на никелевую подложку на воздухе в алундовом тигле. Анодом служил металлический рений. В данной работе было исследовано влияние температуры электролита, плотности тока и концентрации KReO4 на изменение текстуры и структуры осадков, а также на сцепление с подложкой и микротвердость.
Было выяснено, что наибольшее влияние на структуру осадков оказывает концентрация перрената и температура электролита. Повышение температуры от 700-800° С до 900-950° С вызывает переход от кустистой структуры осадка к столбчатой. Одновременно при низкой температуре осадок становится мелкокристаллическим, с нечеткой огранкой поверхности и характерными полусферическими наростами. При высокой температуре поверхность осадка приобретает более однородную макроструктуру и образуется гладкими гранями кристаллов. Преимущественными ориентациями зерен (аксиальные текстуры) являются (101(-)0) и (112(-)0). Переходу от одной структуры к другой способствовало увеличение температуры и снижение концентрации перрената калия. На прочность сцепления покрытия с подложкой в основном влияла концентрация перрената: в пределах концентрации 1-4% сцепление удовлетворительное, при 5 осадок отслаивается от подложки.
Закономерности изменения структуры, текстуры и микротвердости электролитических осадков рения, полученных из вольфраматных расплавов аналогичны хлоридным. Примесью, включаемой в осадок, также как и в хлоридных расплавах, авторы считают оксидные соединения рения (низшие оксиды или рениевые бронзы). Повышение концентрации перрената в расплаве способствует соосаждению оксида рения, повышение температуры, наоборот, способствует осаждению рения с малым содержанием оксида.
3.2 Электроосаждение рения из оксофторидного электролита.
Электровосстановление рения (KReO4) в расплаве эвтектики FLiNaK изучено в работе Affonune A. с соавторами [34]. Катодная часть вольтамперограммы имеет две волны. Электролиз при потенциалах второй волны приводил к образованию металлического рения, поэтому электровосстановление ReO4- во фторидном расплаве авторы описывают следующими реакциями:
ReO4- + (7-x)e → Re(x) + 4O2-
Re(x) + x(e) → Re(0)
В то же время, процесс анодного окисления, по мнению исследователей, сопровождается образованием гексафторида рения:
Re + 6F- → ReF6 + 6e
3.3 Электроосаждение рения из хлоридно-фторидного электролита.
Электровосстановлению рения из хлоридно-фторидного электролита посвящена работа Affonune A. с соавторами. В ней исследовано электрохимическое поведение K2ReCl6 в расплавленной эвтектике LiF-NaF-KF. Авторы считают, что K2ReCl6 восстанавливается до металла в обратимую двухэлектронную реакцию и анодно окисляется с образованием в расплаве Re(III) по обратимому одноэлектронному процессу.
В исследовании Кузнецова С.А. было изучено электрохимическое поведение рения в расплаве NaCl-NaF эвтектического состава. Автор считает, что, по-видимому, в таком расплаве рений присутствует в составе фторидных комплексов, поскольку ИК-спектр застывшего расплава характеризуется полосой поглощения с максимумом 540 см-1, характерным для комплексов ReF62-. Поляризационная кривая такого электролита характеризуется двумя пиками. Потенциостатический электролиз при потенциалах первой волны не приводил к образованию на катоде твердой фазы, стадия проходила обратимо. Потенциостатический электролиз при потенциалах второго пика приводил к выделению металлического рения. Установлено, что вторая стадия протекает необратимо.
3.4 Электроосаждение рения из хлоридного электролита.
3.4.1 Катодный и анодный процесс в хлоридном электролите.
В работе А.Н.Барабошкина и О.Н.Виноградова-Жаброва имеются сведения что в хлоридном электролите без примесей разряд рения идет из Re(IV) с выходом по току, близким к 100%:
Re(IV) → Re(0)
Потенциал восстановления четырехвалентного рения (ReCl62-) до металлического из электролита NaCl-KCl равен около -0,4В относительно хлорного электрода сравнения.
Большое исследование электрохимического поведения рения проведено Кузнецовым С.А. в солевых расплавах рения на основе NaCl, NaCl-KCl, KCl, CsCl. На циклических вольт-амперограммах в электролите на основе NaCl с концентрацией рения 1% по массе автор находит один четкий пик восстановления комплексов рения, соответствующий ему пик электроокисления металла и волна окисления ионов хлора. Стационарные вольт-амперные кривые имели одну площадку предельного диффузионного тока. Потенциостатический электролиз при потенциалах данной волны приводит к образованию на катоде металлического рения. При скорости развертки потенциала <1В/с на катоде происходит обратимое восстановление комплексов рения до металла, а при ≥ 1 В/с процесс разряда становится квазиобратимым. Расчеты автора показали, что стадия переноса заряда трехэлектронная. Стационарные кривые хорошо описываются уравнением Кольтгоффа-Лингейна при числе электронов равным трем.
Автор также считает, что катодный процесс описывается реакцией:
ReCl63- + 3е → Re + 6Cl-
Таким образом методом циклической вольт-амперометрии показано, что в расплаве на основе NaCl присутствую только ионы Re(III).
Иная картина представляется в расплавах на основе KCl и CsCl с концентрацией рения 1% по массе. Вольт-амперометрические исследования, показывают, что при хлорировании рения в этих солях образуется комплекс Re(IV), а не Re(III). На вольт-амперных кривых в катодной области зарегестрировано два пика. Первая стадия является обратимой до скорости развертки <2 В/с, число переносимых электронов равно 1. Вторая трехэлектронная стадия с образованием металлического рения на катоде является обратимой в расплаве KCl при скорости развертки потенциала <1 В/с, а в расплаве CsCl по крайней мере при скорости развертки > 0,125 В/с уже является необратимой.
В эквимолярной смеси NaCl-KCl при хлорировании рения вольт-амперограммы имели такой же вид, как и в расплаве на основе NaCl (данный электролит также имел концентрацию рения не больше 1% по массе). Автор объясняет это тем, что в данном расплаве во второй координационной сфере находятся ионы натрия, но уже при 60 мольных процентах KCl наблюдалось вытеснение внешнесферных катионов натрия и замен их на калий. В расплаве образовывались комплексы Re (IV), четко фиксируемые на циклических вольт-амперограммах по появлению волны электроокисления:
Re (III) - e → Re(IV)
Окисление-восстановление рения, по реакции:
Re (IV) + e ↔ Re(III)
протекает при потенциалах, близких к выделению хлора.
Во всех предыдущих случаях электролиты были достаточно разбавленными по рению. Однако, при электроосаждении рениевых покрытий из расплава NaCl-KCl при температуре 800 °С с концентрацией рения 5% по массе и плотности тока большей 0,05-0,07 А/см2 на катоде выделялся порошок и обнаруживалось выделение соли. При данной концентрации рения на вольт-амперных кривых появлялась новая волна при более отрицательных потенциалах. Потенциостатический электролиз при потенциалах первой волны приводил к образованию компактного рения, при потенциалах второй - к губке или порошку. Кроме этого, при электролизе на потенциале второй волны на катоде происходило образование соли темно-зеленого цвета. По данным кристаллооптического и химического анализов соль отвечала составу K2Re2Cl8. Исходя из данных экспериментов и литературных сведений по полиядерным комплексам рения, автор предлагает механизм получения на катоде этой соли:
4[Re3Cl12]3- + 2K+ +5e -> K2Re2Cl8 + 5[Re2Cl8]3-
Однако следует заметить, что при условиях, в которых получаются порошки рения (800 °С, >0,05А/см2, 5%масс. Re) в других работах получаются сплошные осадки. Это может говорить о том, что условия эксперимента не совпадали, в связи с чем, при проведении электрохимических исследований могли быть представлены искаженные данные.
Анодный процесс растворения рения изучался как в щелочных растворах, так и в расплавах. Основная реакция происходит практически со 100% выходом по току по схеме:
Re(0) → Re(IV)
Анодное растворение рения в расплаве LiCl-KCl сопровождается при низких плотностях тока образованием не только Re(IV), но и Re(III). Последний диспропорционирует на Re(IV) и Re(0).
3.4.2 Структура рениевого покрытия.
Рентгенограмма рениевого покрытия приведена на рисунке 1.
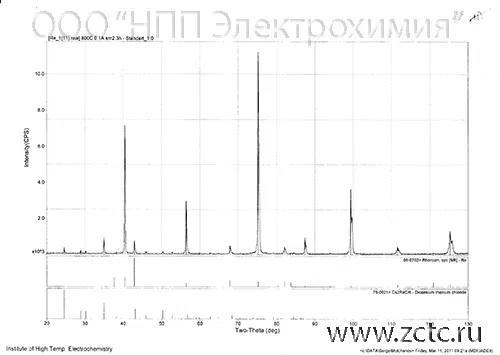
Рисунок 1 — Рентгенограмма рениевого покрытия.
Наибольшее влияние на структуру рениевого покрытия, осажденного из хлоридного электролита, оказывает температура электролиза, катодная плотность тока, катионный состав электролита и наличие в нем примесей (особенно кислорода), а также материал и структура подложки.






Рисунок 2 — Многообразие структур рениевых покрытий, полученных из расплавленных электролитов.
В зависимости от вышеобозначенных условий отмечается четыре типа структур рения, полученных из хлоридных электролитов:
1. Очень темные осадки, иногда растрескивающиеся, пористые. Структура на шлифе не выясняется
2. Серые (бархатистые), очень мелкокристаллические, беспористые. На шлифе поперечного сечения столбчатая тонковолокнистая структура
3. Зеркально-гладкие, блестящие, беспористые. На поверхности встречаются выступы характерной полусферической формы.
4. Структура "черный бархат", образованная щеткой игл в особо чистых по кислороду условиях и высокой плотности тока в электролите на основе NaCl. Покрытие, имеющее такую структуру обладает отражательной способностью близкой к абсолютно черному телу.
Максимальной степенью совершенства текстуры обладают осадки типа 4. Тип 1 характерен для наиболее грязных по кислороду условий, низких температур и высоких плотностей тока. Тип 2 характерен наиболее чистым условиям, наиболее высоким температурам и низким плотностям тока. Тип 3 проявляется в промежуточных условиях - очень узком интервале. При проработке электролита, а также при повышении температуры или снижении плотности тока он переходит в тип 2. Тип 4 возникает при отсутствии кислорода в расплаве и больших плотностях тока.
Переход от одной формы осадка к другой может быть объяснен феноменологически, исходя из числа образующихся зародышей и направлений роста, структуры, величин градиентов электрического, температурного, концентрационных полей, в расплаве, осадке и на границе фаз твердое/жидкое, а также влиянием кислородсодержащих примесей.
Микрораспределение потока осаждаемого вещества при электролизе определяется механизмом и кинетикой электродных реакций, микрогеометрией поверхности, а также ее энергетической и кинетической неоднородностью.
При чисто диффузионной кинетике плоский фронт роста осадка неустойчив, независимо от состава электролита, механизма электродного процесса и токового режима, если только удельное сопротивление осадка не выше, чем эффективное сопротивление расплава.
Любые торможения электродного процесса, локализованные на поверхности осадка либо в непосредственной близости к его поверхности, способствуют повышению равномерности распределения потока осаждаемого вещества на шероховатых поверхностях.
Сглаживающий эффект может быть получен при электроосаждении в следующих случаях:
- При осаждении веществ с удельным сопротивлением выше, чем эффективное сопротивление расплава.
- При осаждении из расплавов, содержащих ионы двух валентных форм, и заторможенном перезаряде ионов высшей валентной формы до низшей.
- При пассивировании растущего осадка примесями, включающимися в осадок.
- При пассивировании осадка примесями или продуктами их восстановления, причем обязательным является то, что восстановление примеси (если она сама является пассиватором) или десорбция продукта ее восстановления должны быть замедленными стадиями.
- При осаждении реверсивным током из комплексных электролитов в режиме, когда в анодный период растворение ведется на предельном токе доставки свободных лигандов к электроду. Необходимым условием является заметная необратимость катодного процесса.
- При наложении достаточной величины температурного поля, градиент которого перпендикулярен макроповерхности катода.
- При осаждении на инородную подложку при образовании на ней сплава.
3.4.3 Рост металлической пленки тугоплавких поливалентных металлов на поверхности хлоридного расплава при электроосаждении.
Для хлоридного электролита характерно образование металлической пленки рения на поверхности расплава, которая, разрастаясь, может замыкать катод с анодом, нарушая нормальный ход электролиза. Данное явление изучалось в работе А.Н.Барабошкина с соавторами.
Пленки такого рода характерны для металлов, образующих летучие высшие галогениды (рений, молибден, титан, цирконий, алюминий) и образуются только в галогенидных ваннах с растворимыми анодами из осаждаемого металла, когда электролиз ведется в атмосфере чистого инертного газа. В этом случае валентная форма ионов в расплаве близка к равновесной с металлом и, как правило, значительно более низкая, чем высшая допустимая валентность данного элемента. Пленки не образуются при электролизе в атмосфере воздуха расплавов, содержащих оксианионы металлов в высшей валентной форме, например вольфраматы, молибдаты.
Пленка не наблюдается при электролизе расплавов нелетучих галогенидов серебра, меди, хрома.
Согласно некоторым исследованиям при электроосаждении молибдена, установлено, что рост металлической пленки происходит со стороны, обращенной к электролиту, а не к газовой фазе. Пленка образуется на границе раздела фаз расплав-газ и расплав-твердое на участке поверхности, непосредственно прилегающей к катоду, и имеет электрический контакт с катодом, утолщаясь в дальнейшем при катодном осаждении на нее металла.
Авторами этих исследований предполагается два принципиально отличных механизма образования пленки.
Первый — на поверхности расплава или кварца еще без тока вследствие диспропорционирования или обменной реакции образуется тончайшая пленка металла (первичная пленка) или какого-нибудь соединения с электронной проводимостью. Сопротивление такой первичной пленки очень велико, поэтому металл нарастает интенсивно только на участках, непосредственно контактирующих с катодом. Однако, такой механизм маловероятен, так как в этом случае ничто не должно препятствовать утолщению пленки при длительной выдержке без тока, чего не наблюдается на практике. Такой механизм, однако, считается маловероятным.
Второй механизм не предполагает существования первично пленки. Избыточная концентрация ионов низшей валентности образуется при катодной реакции. Диффундируя от катода, они диспропорционируют на границе раздела фаз, на которой и катализируется образование зародышей кристаллов металла. Зарождение кристаллов на твердых поверхностях облегчено. Каталитические свойства границы газ-расплав могут быть объяснены адсорбцией частичек различных примесей.
Отмечается, что особенно облегчено диспропорционирование на границе газ-расплав будет в случае, если одним из его продуктов является легко летучий продукт.
3.4.4 Влияние температуры и плотности тока на свойства осадков рения, полученных из хлоридных электролитов.
Влияние температуры и плотности тока на свойства осадков рения изучалось в работах под руководством А.Н.Барабошкина и О.Н.Виноградова-Жаброва.
Изучалось влияние температуры расплава на основе NaCl-KCl на структуру электроосажденного рения в инертной атмосфере. В интервале температур 680 - 750° С авторы выделяли типы структур 1-3. Осадки получались мелкокристаллическими. Зерна осадков имели преимущественную ориентацию (текстуру) с направлением (1000), близким к перпендикуляру подложки. Поверхность была образована гранями, наклоненными к плоскости осадка примерно на 60°. В дальнейшем, при повторных электролизах при тех же плотностях тока и температурах происходило изменение текстур осадков. При более низкой температуре и высокой плотности тока сохранялась текстура (1000).
В интервале температур 750 - 850° С осадки становились более крупнокристаллическими. С увеличением температуры от 750° С полученные слои рения имели текстуру (1100). Совершенство текстуры росло с толщиной осадка. Поверхность была образована гранями, наклоненными к плоскости осадка под углом 31-40°. Грани были зеркально гладкие и образовывали четырехгранные и звездчатые пирамиды с осью симметрии шестого порядка. В последующих осаждениях при увеличении температуры текстура (1100) переходила в (100L), где L менялось от 3 до бесконечности, что соответствует текстуре (0001). Осадки были мелкокристаллическими и микротвердость их уменьшалась. Авторы называют процесс, при котором происходит смена текстур при одних и тех же условиях электролиза "проработкой".
При температурах 850-950° С осадки снова становились мелкокристаллическими.
При граничных условиях могло существовать две текстуры.
Наряду с изменением структуры осадков с повышением температуры менялась микротвердость и напряженность. При повышении температуры осадки становились менее напряженными, микротвердость их уменьшается.
В ряде опытов при температуре выше 750°С отмечались пузыри, не являющиеся следствием дегазации графитового электрода.
В целом с ростом температуры происходит переход текстур роста (1000) → (1100) → (0001).
Сводная информация по зависимости текстур роста рения от температуры и плотности тока приведена в таблице 1, измеренная микротвердость покрытия, полученного при разной температуре и плотности тока 0,1А/см2 приведена в таблице 2.
|
i, А/см2 |
t, °C |
Текстура |
|
0,025 |
850 |
(0001) |
|
0,05 |
850 |
(0001) |
|
0,1 |
850 |
(0001) |
|
0,2 |
850 |
(1100) |
|
0,05 |
730 |
(1100) |
|
0,1 |
730 |
(1000) |
Измеренная скорость осаждения рения при плотности тока 0,1А/см2 в NaCl-KCl электролите была равна 80-83 мкм/час.
|
t, °C |
Ось текстуры |
Hμ на шлифе поперечного сечения осадка относительно подложки |
|
|
Перпендикулярно |
Параллельно |
||
|
700 |
(1000) |
800-900 |
800-900 |
|
800 |
(1100) |
300-450 |
300-450 |
|
900 |
(0001) |
300-320 |
550 |
3.4.5 Влияние катионного состава электролита на свойства осадков рения в хлоридных электролитах.
Хлоридный расплав может быть приготовлен на основе фоновых солей с различными катионами: Li, Na, K, Cs. При этом могут быть использованы не только индивидуальные соли, но и их смеси.
Влияние катионного состава (Na,K,Cs и их смеси) наиболее полно рассмотрено в обобщенной работе О.Н.Виноградова-Жаброва, Л.М.Минченко и соавторов. В работе R.A. Bailey рассматривается состав на основе Li-K.
Методами потенциометрии и полярографии изучалось осаждение рения из LiCl-KCl электролита, содержащего Re(IV) и ReO4-. В ней был установлен потенциал Re(IV)/Re(0), равный -0,389+(5,6*10-4)(t-450) В относительно Pt(II)/Pt(0) электрода сравнения. Температура электролиза 450-550 °С. Рений может быть осажден из данного электролита, но при потенциале около -1В происходит предосаждение Li(0), частично растворяющегося в рении.
Было исследовано влияние катионного радиуса щелочного металла в фоновой соли на структуру и текстуру осадков рения. Так, в работе было установлено, что при использовании электролита на основе NaCl на стенках электролизера в холодной зоне (вверху) почти сразу после расплавления электролита оседали фиолетовые возгоны (по мнению авторов - оксохлориды рения), но время проработки расплава до получения качественных осадков было мало. Осадки с текстурой 0001 получались даже вблизи 800 °С. В электролите на основе CsCl возгонов почти не было, но даже в проработанном расплаве осадки с текстурой 0001 получались при температуре выше 820 °С в инертной атмосфере и выше 950 °С на воздухе.
С увеличением катионного или среднего радиуса для смесей солей и фоновых электролитов в ряду: NaCl → NaCl (50%мол) - KCl (50% мол) → CsCl (52% мол) - NaCl (48% мол) → KCl ->CsCl (65% мол) - NaCl (35% мол) → CsCl (85% мол) - NaCl (15% мол) → CsCl (95% мол) - NaCl (5% мол) → CsCl произошло увеличение температур перехода от (1000) к (1100) и от (1100) к (0001) (кроме CsCl-электролита).
Увеличение температуры перехода текстур с увеличением радиуса катиона или среднего радиуса для смеси фоновых солей фоновых электролитов объясняется уменьшением летучести кислородсодержащих примесей из расплава, в зависимости от комплексообразующей способности соли растворителя. Чем больше средний радиус катионов фонового электролита, тем более прочно удерживаются оксохлориды в расплаве. Аналогичная зависимость перехода от одной текстуры к другой была получена и на воздухе, но температуры перехода были на 100 - 200° С выше, чем под аргоном. несмотря на то, что в цезиевом электролите ожидалась наибольшая температура перехода от одной текстуры к другой, в нем переход от (1000) к (1100) происходил при 720° С, а от (1100) к 0001 около 820°С. Предполагается, что цезий имеет большее сродство к кислороду в расплаве, чем другие катионы, поэтому оксокатионы рения восстанавливаются на катоде в меньшей степени (при более отрицательных потенциалах).
В зависимости от разбавления хлорида цезия хлоридом натрия прослеживалась следующая картина относительно поляризации катода: с уменьшением содержания хлорида натрия от 20% до 10% поляризация увеличивалась, еще большая поляризация наблюдалась в чистом хлориде цезия и максимальная - в расплаве с соотношением CsCl (95%мол) - NaCl (5%мол).
3.4.6 Влияние примесей на свойства осадков рения из хлоридных электролитов.
Влияние кислородсодержащих примесей в расплаве на структуру осадков рения рассмотрено в ряде работ. В них авторы считают вредными примесями в хлоридном расплаве для осаждения рения кислородсодержащие соединения: О2, H2O, CO2, неконтролируемое количество которых вносится при сборке и загрузке электролизера. В дальнейшем, при нагревании и плавлении расплава они образуют оксосоединения рения, возгоняющиеся из расплава благодаря большой летучести. Кроме этого оксокатионы имеют близкие потенциалы восстановления с катионмаи Re(IV), поэтому они могут соосаждаться на катоде. Также была изучена кинетика электроосаждения рения в зависимости от загрязнения системы кислородом. Авторы не исследовали процесс при точном мольном отношении О/Re. Кроме этого, авторы не провели подробных структурных исследований осадков, полученных при различной концентрации кислорода в расплаве.
При концентрации 0,03% массовых кислорода в Na-K расплаве происходит смена текстур (1100) → (1000) при 750° С и (0001) à (1100) при 850° С. На поверхности осадков образуются раковины разной степени закрытости - результат образования пузырей газа. При введении в расплав циркония происходит очистка электролита по реакции:
Zr+2O2- → ZrO2
В очищенном расплаве осадки имели текстуру такую же, как и после введения кислорода.
При введении в расплав 45 см3 кислорода раковины образовывались уже при 0,05А/см2.
Количество кислорода, при котором появляются пузыри, заданного введением перхлората калия непосредственно в электролит и присутствии кислорода в атмосфере над расплавом совпадает.
С увеличением содержания кислородной примеси поляризация на поликристаллическом электроде увеличивается, как на катоде, так и на аноде. Также поляризация уменьшалась с увеличением температуры. Фоновым электролитом в обоих случаях выступал хлорид калия. Также было установлено, что поляризация на монокристаллическом катоде выше, чем на поликристаллическом.
Дополнительно отмечается, что при особо чистых условиях образуется необычная структура рениевых осадков - иглы ("черный бархат").
В некоторых работах предложены химические и электрохимические реакции в электролизере, возникающие при попадании кислорода в расплав. Первоначально происходит химическая реакция взаимодействия гексахлоррената с кислородом по реакции:
2K2ReCl6 + O → ReOCl3 + 4KCl + ReCl5
Оксокатион ReO3+ восстанавливается на катоде (совместно с Re4+) по реакции:
2ReO3+ + 6e → ReO2 + Re
При низких температурах ReO2 внедряется в осадок, что приводит (при больших его количествах) черного порошкообразного покрытия. При высоких температурах оксид рения диспропорционирует по схеме:
7ReO2 → 3Re + Re2O7(газ)
3.4.7 Влияние материала и структуры подложки.
В литературе описано осаждение рения на графитовую, рениевую, вольфрамовую, никелевую и иридиевую подложку.
В работе Н.О.Есиной и Л.М,Минченко изучалась зависимость текстуры рениевых осадков, осажденных из хлоридного калиево-натриевого электролита, в зависимости от текстуры рениевой подложки. Так, было показано, что при осаждении на монокристаллические рениевые фольги происходит эпитаксиальный рост монокристаллических слоев осадка толщиной до 400 мкм. Однако эпитаксиальный рост происходит только в случае совпадения ориентации подложки с осью текстуры роста, формирующейся в осадках рения в этих условиях осаждения.
Морфология поверхности была представлена ограненными пирамидками и ямками. Появление огранки свидетельствует об анизотропии скоростей роста рения в различных направлениях. При увеличении плотности тока поверхность сглаживается, уменьшаются размеры ямок и пирамидок роста. Структура осадков не зависит от радиуса изгиба подложки.
В статье Н.О.Есиной, Л.М.Минченко, А.А.Панкратова изучен эпитаксиальный рост рения, электроосажденного из хлоридного расплава CsCl-Cs2ReCl6 на монокристаллические подложки (прямые и изогнутые) из рения с ориентациями (1000), (1100), (0001) и вольфрама с ориентациями (110), (100), (112), (111). В работе также найдены оптимальные условия эпитаксиального роста на монокристалле рения с ориентациями (0001) и (1100) и показана принципиальная возможность гетероэпитаксиального роста рения на монокристаллических подложках из вольфрама с ориентациями (111) и (100) при определенных условиях электроосаждения из расплава. В статье говорится, что эпитаксиальный рост рения зависит как от условий электролиза, так и от ориентации подложки. Нарушение эпитаксиального роста и формирование текстуры роста в осаждаемом слое рения происходило в случае несовпадения ориентации подложки с направлением оси текстуры роста.
Читайте также статьи
Механизм цинкования
Описание процесса гальванического цинкования. Электролиты.
Механизм анодирования
Анодное оксидирование алюминия.Механизмы процесса.
Фосфатирование стали
Механизм и технология химического процесса. Составы растворов.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



