
Механизм и технология гальванического кадмирования металла.
Содержание:
2. Катодные процессы при кадмировании.
1. Что такое кадмирование?
Кадмирование — процесс нанесения тонкого слоя металлического кадмия на изделие для придания ему необходимых свойств. Основное назначение покрытия - защита стали от коррозии в солевой среде (морской воде и тропиках).
Кадмий — серебристо-белый металл, по своим свойствам близок к цинку, но в десятки раз дороже его. Он легко куется, вальцуется в листы, полируется. Плотность металлургического кадмия - 8,6 г/см3, температура плавления составляет 321° С, удельное электрическое сопротивление кадмия составляет 0,076*10-6 Ом*м.
Заметная пассивация кадмия наступает во влажной среде, а при 200° C пассивная пленка утолщается, приобретая соломенно-желтый цвет. Пассивная пленка на кадмии, по сравнению с цинком, более плотная. Кадмий легко диффундирует в основной металл и на границе "металл-покрытие" образуется сплав.
Кадмий растворим в минеральных кислотах, особенно в азотной. При этом реакционная способность кадмия ухудшается с ростом его чистоты. В отличие от цинка кадмий не растворим в щелочах и не проявляет амфотерных свойств. Гидроксид кадмия растворяется в аммиаке. С цианидами кадмий образует плохо растворимый цианид кадмия. Однако, в избытке цианистого калия этот осадок растворяется с образованием комплексной соли.
Пары и соединения кадмия крайне ядовиты. Первыми признаками отравления являются тошнота и головная боль. Кадмий ни в коем случае не должен соприкасаться с пищевыми продуктами.
Кадмиевые покрытия известны достаточно давно. Их изучением занимались Мюллер, Бархманн, Верник, Изгарышев Н.А., Орлова С.И., Кудрявцев Н.Т., Осипова Е.В., Планер и ряд других ученых. Основное применение таких покрытий - защита стали от коррозии. В этом вопросе не все так однозначно, как с цинком. Длительное время шли споры о том - положительнее кадмий железа или отрицательнее, т.к. потенциалы этих металлов оказались близки. Ответ на этот вопрос кроется в том, что потенциалы металлов в растворах зависят от целого ряда факторов:
- состав среды;
- состав покрытия и основы;
- пористость покрытия;
- предшествующая обработка основы и пр.
Оказалось, что кадмий может быть как анодом, так и катодом по отношению к стали.
Анодный характер защиты кадмия проявляется в хлорид-содержащих средах (в частности - в морской воде). При несплошности солевой среды (туман, брызги) анодный характер защиты сохраняется.
В условиях сухого атмосферного воздуха кадмий по отношению к стали - катод. В атмосфере промышленных серосодержащих газов кадмий разрушается в 1,5-2 раза быстрее цинка, т.к. образующийся на поверхности покрытия слой сульфида кадмия легко смывается дождями. Также кадмиевые покрытия не устойчивы в среде продуктов, выделяющихся при старении олифы, масляных лаков.
Как и цинк кадмий подвергается хроматированию для улучшения его защитных свойств. В зависимости от условий эксплуатации стальных изделий толщина кадмиевых покрытий устанавливается в следующих размерах:
|
Обозначение покрытия |
Назначение покрытия |
Толщина кадмия, мкм, |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
||
|
Кд |
Защитное |
- |
- |
- |
- |
- |
30 |
30 |
40 |
|
Кд.хр |
Защитное; защитно-декоративное |
- |
- |
- |
12 |
- |
18 |
18 |
18 |
Твердость покрытий кадмием варьируется от 600 до 1500 МПа. Таким образом, кадмий мягче цинка и несколько тверже олова.
Кадмиевые покрытия отличаются высокими антифрикционными свойствами, но низкой износостойкостью.
2. Катодные процессы при кадмировании.
Гальваническое кадмирование производится как из щелочных цианистых, так и из кислых растворов. Изначально были предложены хлоридные, бромидные, сульфатные растворы и цианидные растворы. Позже были разработаны перхлоратные, кремнефтористоводородные, фенолсульфоновые, пирофосфатные, борфтористоводородные, сульфатно-аммонийные, хлоридно-аммонийные и уротропиново-аммонийные растворы.
2.1 Цианидный электролит кадмирования.
В щелочном растворе кадмирования идут реакции:
Na2Cd(CN)4 ↔ 2Na+ + Cd(CN)42-
Cd(CN)42- ↔ Cd2+ + 4CN-
Cd2+ + 2e = Cd
Процесс сопровождается значительной катодной поляризацией, характерной для комплексных электролитов.
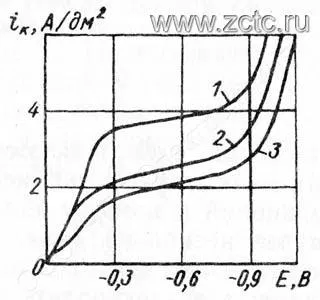
Зависимость хода поляризационных кривых при кадмировании из цианидной ванны от ее состава показана на рисунке 1 и 2.

Рисунок 1 — Поляризационные кривые при осаждении кадмия из цианистых растворов с различным содержанием цианида натрия (г/л): 1 - 150, 2 - 125, 3 - 22. Содержание оксида кадмия во всех случаях 35 г/л.
Обязательной добавкой в цианистый электролит кадмирования является щелочь. Ее влияние на ход кривых показано на рисунке 2.
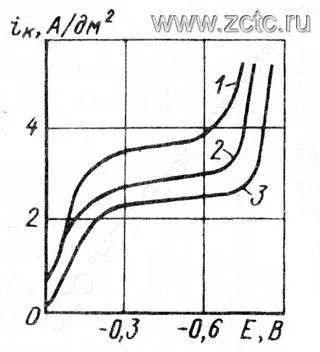
Рисунок 2 — Поляризационные кривые при осаждении кадмия из цианистых растворов с различным содержанием гидроксида натрия (г/л): 1 - 20, 2 - 40, 3 - 60. Содержание оксида кадмия во всех случаях 35 г/л, цианида натрия - 90 г/л.
Ни рисунке 3 показана зависимость катодного выхода по току при кадмировании из цианидной ванны от плотности тока и температуры.
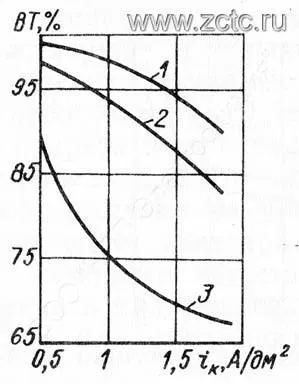
Рисунок 3 - Зависимость выхода по току при цианистом кадмировании от плотности тока и температуры (оС): 1 - 60, 2 - 35, 3 - 18.
2.2 Кислые электролиты кадмирования.
Простые кислые электролиты дешевле, проще и менее токсичны, чем цианидные. В них идут реакции:
Cd2+ + 2e = Cd
2H+ + 2e = H2
Ход поляризационных кривых в зависимости от анионного состава кислых ванн приведен на рисунке 4.
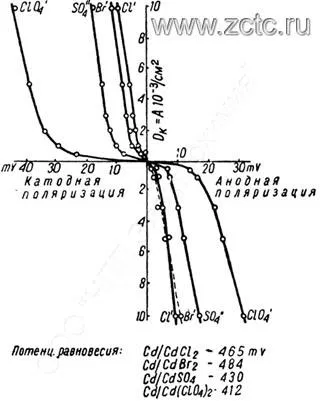
Рисунок 4 — Влияние аниона на поляризацию при кадмировании из кислых растворов.
Из рисунка 4 видно, что анионы по степени влияния на катодную и анодную поляризацию можно расположить в ряд: Cl-< Br- < SO42-<BF4- < ClO4-.
Повышение температуры во всех случаях снижает поляризацию, как показано на рисунках 5 и 6.
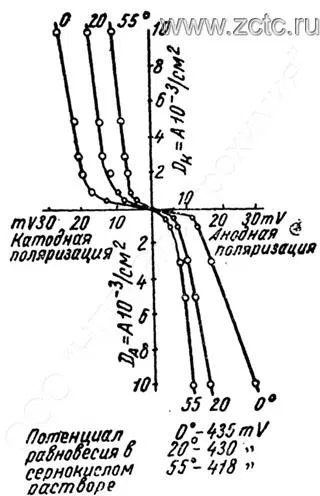
Рисунок 5 — Влияние температуры на ход поляризационных кривых в 1Н растворе сульфата кадмия и 0,1Н серной кислоты.

Рисунок 6 — Влияние температуры на ход поляризационных кривых в 1Н растворе перхлората кадмия и 0,1Н хлорной кислоты.
Введение ПАВ (на примере желатины) логично увеличивает поляризацию, что видно на рисунках 7 и 8.
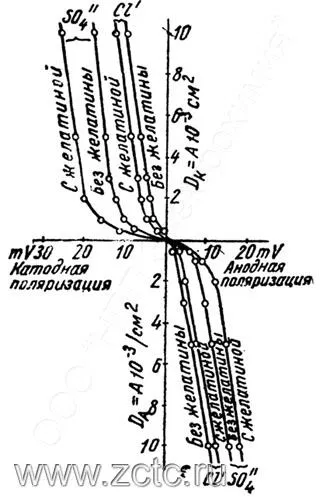
Рисунок 7 — Влияние ПАВ (желатин) на катодную поляризацию при кадмировании из сернокислых и хлоридных растворов.
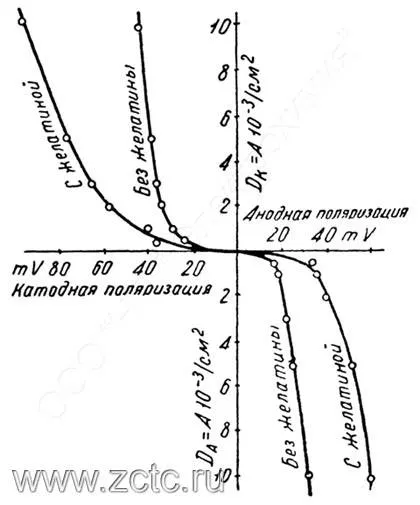
Рисунок 8 — Влияние ПАВ (желатин) на катодную поляризацию при кадмировании из 1Н раствора перхлората кадмия и 0,1Н хлорной кислоты.
Влияние рН сернокислого раствора кадмирования на ход процесса сводится к следующему. В ходе электролиза рН непрерывно растет. После рН=6 мелкокристаллическая структура осадков сменяется на крупнокристаллическую, осадки приобретают серый цвет. Оптимальным является уровень рН=5-5,7.
Плотность тока не сильно влияет на выход по току в сернокислом электролите, в отличие от цианидного (рисунок 9).
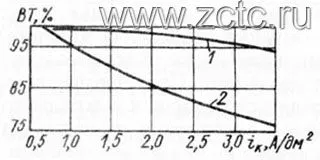
Рисунок 9 — Зависимость выхода по току от плотности тока при кадмировании: 1- сернокислый электролит, 2 - цианидный электролит.
В простых электролитах катодный выход по току также не сильно зависит от анионного состава и температуры (рисунок 10).
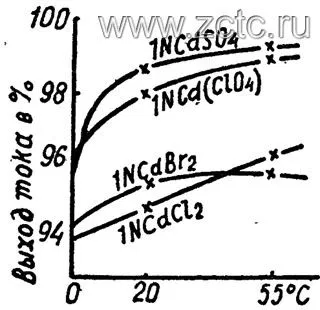
Рисунок 10 — Влияние анионного состава и температуры на выход по току при кадмировании.
Повышение плотности тока не сильно влияет на структуру кадмиевого покрытия из сернокислого раствора.
2.3 Борфтористоводородный электролит кадмирования.
Влияние различных факторов на ход поляризационных кривых при кадмировании из борфтористоводородного электролита показано на рисунке 11
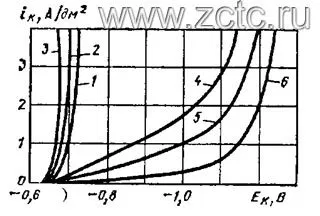
Рисунок 11 — Катодные поляризационные кривые при кадмировании из борфтористоводородного электролита (43 г/л борфтористоводородного кадмия и 35 г/л борфтористоводородной кислоты: [1-3] - без ПАВ, [4-6] - с добавкой 2 г/л ДЦУ + 2 г/л ОС-20. Температуры (°С) - 1,6 - 20; 2,5 - 40; 4 - 50.
2.4 Пирофосфатный электролит кадмирования.
Характеристика кинетики осаждения кадмия из пирофосфатного электролита приведена на рисунках 12 и 13.
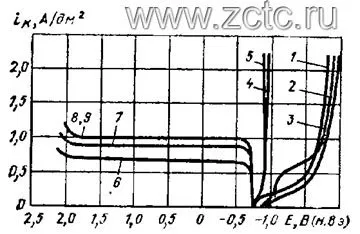
Рисунок 12 — Катодные (1-5) и анодные (6-9) поляризационные кривые в пирофосфатном электролите кадмирования, содержащей 192 г/л пирофосфата калия при рН = 8, температуре 50° С при концентрации сульфата кадмия в форме кристаллогидрата (г/л): 1,2,4-9 - 9,2; 3 - 22. 1 - без Трилона Б, 2,3,9 - 36,2 г/л Трилона Б; 4,5 - частота вращения катода 330 и 1200 об/мин. соответственно, 7,8 - с добавкой K2HPO4.
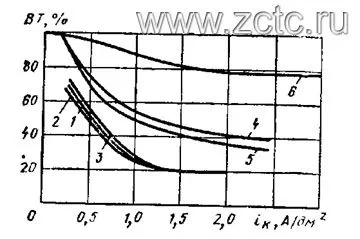
Рисунок 13 — Зависимость катодного выхода по току от плотности тока в пирофосфатном электролите кадмирования, содержащем 192 г/ пирофосфата калия при рН = 8. Концентрация кристаллогидрата сульфата кадмия (г/л): 1-3 - 4,6; 4,5 - 9,2; 6 - 22; 1-4 - без Трилона Б, 5,6 - 37,2 г/л Трилона Б, 1-2 - при 20° С; 3-6 - при 50° С.
2.5 Сравнительный анализ кинетики осаждения кадмия.
Сравнительный вид катодных поляризационных кривых при кадмировании из разных типов растворов приведен на рисунке 14.
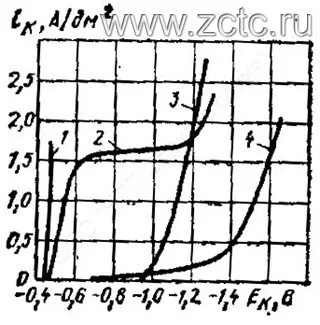
Рисунок 14 — Сравнительные катодные поляризационные кривые в различных электролитах кадмирования: 1 - сернокислый без ПАВ, 2 - сернокислый с ПАВ, 3 - цианистый, 4 - пирофосфатный.
Заказать кадмирование металла в Екатеринбурге Вы можете по телефону в верхнем правом углу сайта. Оказываем услуги по кадмированию в рамках ГОЗ.
Читайте также статьи
Что такое гальваника?
Теоретические основы нанесения гальванических и химических покрытий.
Механизм анодирования
Анодное оксидирование алюминия. Механизмы процесса.
Фосфатирование стали
Механизм и технология химического процесса. Составы растворов.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



