
Виды коррозии металлов. Классификация процессов. Механизмы коррозии.
Содержание:
1. Почему металл корродирует?
2. Классификация коррозионных процессов по определяющему механизму.
3. Классификация коррозионных процессов по условиям протекания коррозии.
4. Классификация коррозионных процессов по характеру коррозионного разрушения.
5. Коррозия отдельных металлов.
1. Почему металл корродирует?
Жизнь современного человека нельзя представить без металлов. Они окружают нас везде - это и бытовая техника в наших домах, и транспортные средства, на которых мы добираемся до дома или работы, и смартфоны, без которых многие из нас не представляют жизнь. Почти всё, что нас окружает состоит из металлов, но, к сожалению, как и всё в этом мире, они не вечны и под действием внешней среды разрушаются - корродируют.
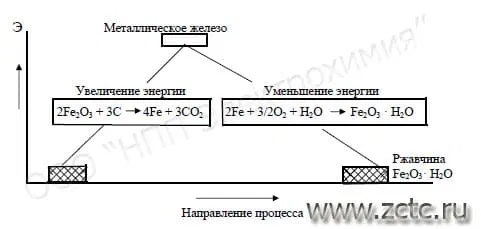
Почему коррозия «выгодна» для металлов? Дело в том, что большинство из них существуют в природе в химически связанном состоянии, например, в виде оксидов (корунд) или сульфидов (пирит). В чистом виде почти все металлы неустойчивы и чтобы выделить их из соединений приходится затрачивать немалую энергию. Обратный же процесс, когда металлы переходят в связанное состояние, всегда термодинамически более выгоден. Поэтому он происходит самопроизвольно, а металлы при любой возможности стремятся вступить в реакцию со своим окружением и перейти в более устойчивую форму. Иллюстрация этого представлена на рисунке 1.

Рисунок 1 – Схема восстановления металла из руд с последующей коррозией (окислением). Э – условный уровень энергии.
Коррозия приводит к огромным экономическим затратам, а её следствием становятся глобальные экологические катастрофы. Потеря металлофонда от коррозии составляет порядка 12% в год.
Помимо прямых потерь существуют и косвенные потери, вызываемые коррозией:
- из-за простоя оборудования вызванных авариями;
- из-за снижения мощностей оборудования;
- из-за снижения качества продукции;
- на ликвидацию последствий аварии;
- на ремонт оборудования;
- на дальнейшую защиту от коррозии.
2. Классификация коррозионных процессов по определяющему механизму.
2.1 Химическая коррозия металлов.
Химическая коррозия – это процесс взаимодействия металла с коррозионной средой. Такая коррозия не сопровождается протеканием электрического тока и обычно идет при отсутствии влаги.
Химическая коррозия подчиняется законам кинетики гетерогенных реакций. Пример - окисление магния на воздухе:
2Mg + O2 = 2MgO
Термодинамическую устойчивость металла можно оценить по изменению свободной энергии Гиббса в коррозионной реакции. Коррозия возможна, если энергия Гиббса меньше нуля ∆G <0.
Например, для окисления железа на воздухе по реакции:
3Fe + 2O2 = FeO + Fe2O3
изменение энергии Гиббса имеет вид:
∆G =υ∆G0FeO + υ∆G0Fe2O3 – υ∆G0Fe – υ∆G0O2
где:
∆Gх0 – изменение энергии Гиббса отдельных компонентов, кДж/моль;
υ – стехиометрический коэффициент реакции.
∆G0 = 1*(-244,3) +1*(-740,3) – 3*0 – 2*0 = -984,6 кДж/моль.
∆G0 = -984,6 кДж/моль, из чего можно сделать вывод, что реакция окисления железа протекает самопроизвольно.
Примеры изменения ∆G для некоторых других металлов представлены в таблице 1.
|
Реакция |
∆G, кДж/моль |
Реакция |
∆G, кДж/моль |
|
4Na+O2 = 2Na2O |
-340,4 |
4Cr+3O2 = 2Cr2O3 |
-15,3 |
|
2Mg+O2 = 2MgO |
-307,4 |
2Ni+ O2 =2NiO |
-102,6 |
|
4Al+3O2 = 2Al2O3 |
-239,4 |
2Pb+ O2 =2PbO |
-90,9 |
|
2Zn+O2 = 2ZnO |
-153,6 |
4Ag + O2 =2Ag2O |
-8,51 |
|
4Au+3O2 = 2Au2O3 |
+65,73 |
2Pt + O2 =2PtO |
+36 |
В зависимости от условий эксплуатации устойчивость металлов может существенно меняться. Для большинства из них с ростом температуры термодинамическая вероятность окисления снижается.
2.2 Электрохимическая коррозия металлов.
Электрохимическая коррозия – это процесс взаимодействия металла с коррозионной средой (электролитом), сопровождающийся окислением металла и восстановлением акцептора из коррозионной среды.
Электрохимическая коррозия подчиняется законам электрохимической кинетики. Она представляет собой переход металла из свободного состояния в связанное с потерей электронов. Скорость такой коррозии зависит от электродного потенциала самого металла.
Современная теория, объясняющая электрохимическую коррозию, была предложена советским учёным, доктором химических наук Яковом Михайловичем Колотыркиным.
В основе этой теории лежит предположение, что вся поверхность металла равнодоступна и для катодной для анодной составляющей процесса коррозии.
Электрохимическая коррозия включает в себя 4 основных стадии (рисунок 2):
- Растворение металла Me (ионизация) и высвобождение электронов (е);
- Перенос электронов по металлу (количество их в элементарной стадии - z);
- Восстановление деполяризатора D (присоединение е);
- Перенос ионов по раствору электролита.
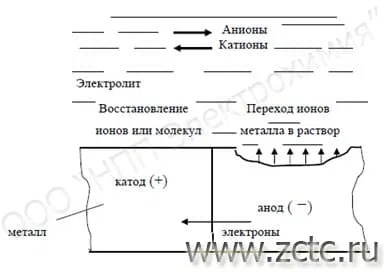
Рисунок 2 – Схема работы коррозионного элемента.
Электрохимическая коррозия представляет собой совокупность двух протекающих реакций:
• на аноде:
Me0 - zе = MeZ+
• на катоде:
DZ+ + zе = D0
Термодинамическая возможность протекания электрохимической коррозии определяется равновесным потенциалом, если он больше 0, то коррозия возможна.
∆Ep = Еox - Еred = ЕD - EМе> 0
Из формулы можно сделать вывод, что реакция возможно тогда и только тогда, когда потенциал деполяризатора больше потенциала металла ЕD > EМе.
Деполяризаторы в водных растворах:
• в кислых средах:
2H+ + 2е = H2
O2 + 4H+ + 4е = 2H2O
• в нейтральных и щелочных:
2H2O + 2е = H2 + 2OH-
O2 + 2H2O + 4е = 4OH-
Если в качестве деполяризатора выступает гидроксил ион или вода, то принято говорить, что коррозия идёт с водородной деполяризацией, если деполяризатором выступает кислород – кислородная деполяризация. Очень часто бывают случаи смешанной деполяризации, при ней одновременно восстанавливаются и водород, и кислород.
2.3 Биологическая коррозия металлов.
Биокоррозия – это разрушение металла, вызванное непосредственно или косвенно жизнедеятельностью бактерий, плесени и грибов.
Данному типу коррозии подвержены абсолютно все материалы и изделия известные человеку. Это обусловлено образованием окислительных ферментов, вызывающих разрушение различных субстратов с образованием органических кислот. Данные кислоты также оказывают разрушающее действие на материалы.
Например, вырабатываемые грибками органические кислоты вызывают питтинговую коррозию углеродистой стали в трюмах или алюминиевых топливных баков.
2.4 Кавитационная коррозия металлов.
Кавитационная коррозия – это разрушение, возникшее вследствие удара под воздействием текучей среды (потока жидкости или газа). Проявляется при схлопывании на поверхности металла пузырьков газа, сопровождающееся гидравлическим ударом.
2.5 Эрозия.
Эрозия – износ и выбивание частиц металла с поверхности под влиянием твёрдых частиц, находящихся в потоке жидкости. Эрозия металла ускоряется коррозионным действием среды. Иными словами, потеря материала происходит не только вследствие механического действия потока, но и в результате некоторого электрохимического процесса. Иллюстрация процесса эрозии приведена на рисунке 3.
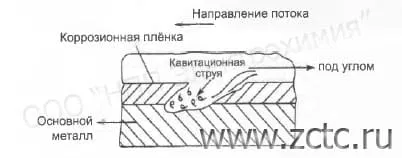
Рисунок 3 – Пример эрозионной коррозии.
3. Классификация коррозионных процессов по условиям протекания коррозии.
- Газовая коррозия протекает в газовой фазе с минимальным количеством влаги. Данная коррозия возникает при контакте металлов с агрессивными газами (галогены, кислород, оксид серы).
- Атмосферная коррозия протекает в атмосфере воздуха или другого влажного газа.
- Жидкостная коррозия – это коррозия, протекающая в различные рода жидкостях.
- Подземная коррозия – это коррозия металла, возникающая в следствии неоднородностей почвы, грунта.
- Коррозия в условиях криптоклимота происходит в условиях замкнутого пространства.
- Радиационная коррозия вызвана действием радиационного излучения.
- Морская коррозия возникает из-за депассивирующего свойства ионов хлора.
- Структурная коррозия связанна со структурной неоднородностью металлов.
- Коррозия, возникающая под действием блуждающих токов.
4. Классификация коррозионных процессов по характеру коррозионного разрушения.
4.1 Контактная коррозия.
Контактная коррозия образуется при контакте разных металлов в присутствии электролита или влажного воздуха. В образовавшейся гальванопаре, металл с более электроотрицательным потенциалом становится анодом и разрушается в первую очередь, тогда как более электроположительный металл – катодом.
В качестве примера можно рассмотреть железо (рисунок 4). Цинк, алюминий и кадмий (последний - в солевой среде) являются анодами для стали, а значит именно они будут окисляться в первую очередь, тогда как олово, хром, медь, свинец, никель – катодами, а значит железо будет подвержено глубокой локальной коррозии, пример изображён на рисунке.
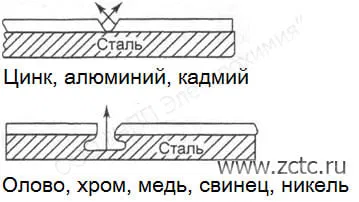
Рисунок 4 – Примеры контактной коррозии на стали.
4.2 Щелевая коррозия.
Щелевая коррозия – это коррозия, возникающая в случаи, если часть металла изолирована от основного участка неметаллическим материалом (резиной, деревом, пластиком и т.д.). Пример такой коррозии можно наблюдать в трубах в месте соприкосновения с сальником (рисунок 5). Образование полости под сальником вызывает протечки в трубах. При наличии таких неровностей коррозионная жидкость застаивается в щели, где и происходит бурная коррозия металла.
Причиной щелевой коррозии является пониженная концентрация окислителей в зазорах по сравнению с объёмом раствора и замедленный отвод продуктов коррозии. В результате их накопления меняется pH раствора в щели, что так же ускоряет коррозию.
Металл в щели и металл открытой поверхности образуют макропару:
Me - 2е = Me2+ (внутри щели)
0,5О2 + H2O + 2е = 2ОН- (на поверхности металла)
Поскольку площадь открытой поверхности гораздо больше, чем внутри щели, плотность тока коррозии внутри щели оказывается чрезвычайно высокой.
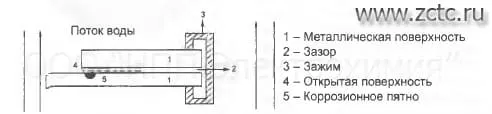
Рисунок 5 – Кислородная концентрационная ячейка под сальником.
По мере протекания коррозии внутри щели накапливается избыточный положительный заряд. Ионы ОН- устремляются в щель, чтобы нейтрализовать этот заряд. В результате, на внутренней поверхности щели осаждается гидроксид металла, что ещё больше сокращает эффективную площадь анода.
4.3 Питтинговая коррозия.
Питтингом называют глубокие поражения (точечные язвы) на поверхности металла (рисунок 6). Питтинговая коррозия, вследствие своей локализованности и малой заметности, является одним из наиболее опасных видов коррозионного разрушения. Не следует путать питтиговую коррозию с питтингом на никелевых покрытиях.
Так как пассирующий слой на поверхности металла не является гомогенной системой, то коррозия возникает из-за наличия анодных и катодных участков на поверхности. В возникшей гальванопаре анодом является питтинг, а катодом – остальная часть поверхности. На аноде происходит высвобождение электронов, которые восстанавливают кислород на катодной пассивированной части поверхности.
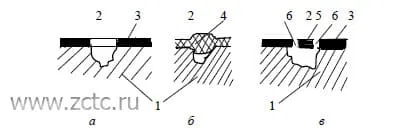
Рисунок 6 – Виды питтингов: а – открытый с защитным слоем на окружающей поверхности; б – закрытый, без окружающего защитного слоя; в – закрытый, с окружающим защитным слоем. 1 – металл; 2 – раствор; 3 – защитный слой; 4 – пористые продукты коррозии; 5 – крышка над питтингом; 6 – отверстия в крышке.
Развитию питтинга способствуют различного рода дефекты на поверхности пассивной плёнки, например, царапины, сколы, поры, посторонние включения. Также для возникновения питтинга необходимо, чтобы в растворе одновременно находились активаторы питтинговой коррозии (Cl-, Br-, J-, CN-) и пассиваторы металла (OH-, SO42-, NO3-,ClO4-).
4.4 Межкристаллитная коррозия.
Межкристаллическая коррозия возникает из-за разницы потенциалов на границе зерна и в его матрице (рисунок 7).
На воздухе на границе зерна образуется карбидная фаза, что сдвигает потенциал в область более электроотрицательных значений. Таким образом граница зерна является анодом по отношению к их матрице.
Наиболее опасен данный тип коррозии для сплавов, так как в месте скопления более электроотрицательного металла будет образовываться анод, а основного – катод. Например, для нержавеющих сталей, содержащих хром, вблизи границ зёрен содержание хрома оказывается ниже, чем на остальной поверхности, что делает их менее пассивированными. Вследствие этого такие места становятся анодами по отношению к матрице зерна.
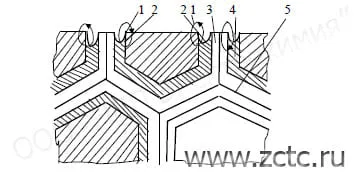
Рисунок 7 – Межкристаллическая коррозия нержавеющей стали: 1 – катод; 2 – анод; 3 – карбидная фаза; 4 – зона, обеднённая хромом; 5 – граница зёрен.
4.5 Фреттинг-коррозия.
Фретинг-коррозия происходит между двумя поверхностями, находящимися в непрерывном контакте друг с другом и совершающими малые колебания. Поверхности никогда не отрываются друг от друга, поэтому в точках механического контакта происходит накопление осколков продуктов коррозии.
Данная коррозия возникает при незначительных колебаниях, циклических или возвратно-поступательных движений с малыми амплитудами и скоростями.
Этой коррозии подвергаются болты, заклёпки, шарниры, муфты, клапаны, детали двигателей и пр.
4.6 Коррозионное растрескивание под напряжением.
Коррозионное растрескивание под напряжением возникает, когда металлическое изделие подвержено растяжению в коррозионной среде. Тогда даже при напряжениях ниже напряжения разрушения происходит растрескивание, в конце концов, приводящее к разрушению конструкции или изделия.
На растянутых участках металла идёт коррозия, поскольку они оказываются анодами по отношению к нерастянутой части. Это явление наблюдается на любых металлах и сплавах, а также в любых средах.
4.7 Коррозионная усталость.
Коррозионная усталость возникает вследствие одновременного воздействия агрессивной среды и механической нагрузки.
Коррозионная усталость часто бывает причиной «неожиданного» разрушения металлических деталей, так, если деталь, находящаяся в коррозионном окружении, подвержена непрерывным вибрациям, её разрушение происходит при напряжении гораздо ниже предела выносливости.
5. Коррозия отдельных металлов.
Скорости годовой коррозии некоторых металлов и сплавов в различных средах приведены в таблице 2.
|
Металл |
Серная 5% |
Уксусная 5% |
Азотная 5% |
NaOH 5% |
Пресная вода |
Морская вода |
Городской воздух |
|
Алюминий |
8-100 |
0,5-5 |
15-80 |
13000 |
0,1 |
1-50 |
0-0,5 |
|
Цинк-олово |
Высокая |
600-800 |
Высокая |
0,5-10 |
0,5-10 |
0,5-10* |
0-0,2 |
|
Свинец- железо |
2-500- |
2-500* |
100-1000 |
0-0,5 |
0-0,5 |
0,2-15 |
0-0,2 |
|
Кремний- железо |
0-2 |
10-150* |
100-6000 |
0,1-2 |
0,1-2 |
0,2-15 |
0-0,2 |
|
Сталь |
15-100* |
10-100 |
1000-10000 |
0,1-10* |
0,1-10* |
0,1-10* |
0,2 |
|
Нержав. сталь |
0-5 |
0-0,2 |
20 |
0-0,2 |
0-0,2 |
0-3 |
0-0,2 |
|
Медные сплавы |
0-100 |
0-0,5 |
0-2 |
0-0,2 |
0-0,2 |
0-200 |
<0,1 |
|
Никель |
2-50 |
2-15* |
150-1500 |
0-1 |
0-1 |
0,2-15* |
<0,1 |
|
Никелевые сплавы |
2-35* |
2-10* |
0,1-1500 |
0-1 |
0-1 |
0,2-15* |
<0,1 |
|
Титан |
10-100 |
<0,1 |
<0,1-1 |
<0,2 |
<0,1 |
<0,1 |
<0,1 |
|
Молибден |
0-0,2 |
<0,1 |
Высокая |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
|
Цирконий |
<0,5 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
|
Тантал |
<0,1 |
<0,1 |
Высокая |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
|
Серебро |
0-1 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
- |
|
Платина |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
- |
|
Золото |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
- |
5.1 Коррозия железа и сталей.
Самыми распространёнными конструкционными металлами были и остаются сплавы на основе железа - стали (С < 2,14% от общей массы) и чугуны (C > 2,14% от общей массы). Железо наиболее подверженный атмосферной коррозии металл по причине выделения водорода и кислородной деполяризации. Для стали наиболее опасна питтинговая коррозия.
Коррозия железа начинает протекать при относительной влажности более 75%. Если необходимый для деполяризации кислород отсутствует, то в качестве акцептора электронов могут выступать ионы железа (III), восстанавливаясь до железа (II), которые затем взаимодействуют с кислородом и окисляются снова до железа (III).
2Fe2+ + 2H+ + 0.5O2 = 2Fe3+ + H2O
Таким образом ионы железа (III) выступают в роли переносчика кислорода, ускоряя коррозию.
Реакция коррозии железа в атмосферном воздухе приведена в начале статьи.
Образование оксидной защитной плёнки на поверхности железа возможно только в присутствии сильного окислителя, например, азотная кислота. В обычных же условиях окисная пленка на железе рыхлая и пористая, т.е. не способна защитить его от коррозии.
Для защиты от коррозии сталь легируют добавлением некоторых компонентов. Их влияние можно обобщить следующим образом:
- Медь до 0,2% повышает коррозионную стойкость в атмосферных условиях.
- Фосфор до 0,1% в комбинации с медью также повышает коррозионную стойкость, но никак не защищает от питтинга.
- Хром и никель снижают скорость коррозии благодаря тому, что образуют на поверхности стали защитную плёнку. Хром в количестве 13% существенно замедляет скорость коррозии. При легировании хромом более 30% сталь становится также устойчива и к питтинговой коррозии.
- Кремний повышает стойкость против питтинговой коррозии, но увеличивает вероятность межкристаллической коррозии.
При использовании материалов на основе железа в прибрежной атмосфере следует применять катодную защиту. В промышленности, поверхность сталей следует защищать от коррозии защитными покрытиями, а также применять подходящие ингибиторы коррозии. Чаще всего в качестве защитного покрытия применяют цинк и его сплавы, кадмий, порошково-полимерные и цинкнапоолненные краски.
5.2 Коррозия алюминия и его сплавов.
Вторым по популярности конструкционным материалом являются сплавы на основе алюминия. Потенциал алюминия -1,66 В, что свидетельствует об его высокой активности и реакционноспособности. Несмотря на это, алюминий имеет большую склонность к пассивации и обладает высокой стойкостью к атмосферной коррозии. В пассивном состоянии поверхность алюминия покрыта тонкой плёнкой оксидов (байерит). Однако данная плёнка устойчива только в нейтральных средах (4,5 < pH < 8,5). В концентрированных кислотах неокислительного характера или в щелочах алюминиевые изделия подвергаются сильной коррозии.
Реакция взаимодействия алюминия с кислородом:
4Al + 3O2 = 2Al2O3
Реакция взаимодействия алюминия с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2
Чистый алюминий проявляет высокую коррозионную стойкость и пластичность, но обладает низкой механической прочностью. Для повышения прочности и способности к тепловой обработке добавляют легирующие компоненты.
Добавление легирующих компонентов, потенциал которых более электроположительный чем потенциал алюминия, приводит к образованию катодных и анодных зон. Например, при добавлении в сплав меди образуется интерметаллидная фаза CuAl3. Являясь катодом по отношению к основному металлу, CuAl3 осаждается на границе зерна, из-за чего области вблизи этих границ оказываются обеднёнными медью и будут являться анодами по отношению к самим границам зёрен, вызывая межкристаллитную коррозию.
Частным случаем коррозии алюминия с участием интерметаллидов являются так называемые "черные точки". Коррозия такого типа идет в три этапа:
- появление черных точек на поверхности алюминия в зонах локальной концентрации интерметаллидов;
- чёткое проявление границ интерметаллидов;
- растворение интерметаллидов и образование несплошностей в виде глубоких питтингов и язв.
На крупногабаритных деталях этот эффект проявляется особенно сильно. Часто точки могут возникать при травлении и анодировании алюминия. Сразу после травления точки могут быть не видны, т.к. они скрыты под слоем травильного шлама. Но если деталь промыть и дать высохнуть на воздухе, то со временем шлам желтеет и черные точки становятся легко различимы невооруженным глазом (рисунок 8).

Рисунок 8 - Пример черных точек на травленом алюминии Д16.
Стандартные электродные потенциалы различных сплавов алюминия и некоторых интерметаллидов приведены в таблице 3.
|
Сплав или интерметаллид |
Вид полуфабриката |
Стационарный потенциал, мВ |
|
Д16чТ |
панель |
-595 |
|
1973Т2 |
плита |
-685 |
|
В95пчТ2 |
прессованная полоса |
-675 |
|
В95пчТ3 |
штамповка |
-700 |
|
Al2Mg3Zn3 |
- |
-1215 |
|
CuAl2 |
- |
-610 |
|
Al2CuMg |
- |
-720 |
* За стационарные потенциалы принимали потенциал, установившийся через 24 часа в 3%-м рас-творе хлорида натрия по хлорид-серебрянному электроду.
Добавление более электроотрицательных компонентов, таких как магний, увеличивает пассивацию алюминия, благодаря чему коррозионная стойкость возрастает.
Наиболее популярными покрытиями для защиты алюминия и его сплавов от коррозии являются анодирование, химическое никелирование и многослойные покрытия на основе меди, никеля, серебра и олова.
5.3 Коррозия меди и её сплавов.
Чистая металлическая медь имеет потенциал 0,337 В, благодаря чему в обычной атмосфере обладает неплохой коррозионной стойкостью. Она не разрушается под действием неокисляющих кислот или в присутствии депассиватора. Разрушение меди начинается в присутствии окисляющих кислот (азотная кислота и пр.), органических кислот, а также комплексообразователей.
Несмотря на то, что медь практически не взаимодействует с кислородом, при контакте с влажным воздухом медь начинает разрушаться. Образовавшиеся продукты коррозии нерастворимы и предотвращают дальнейшую коррозию металла.
2Cu + H2O + CO2 + O2 → CuCO3 + Cu(OH)2↓
Из-за высокой теплопроводности и неплохой коррозионной стойкости в воде медь популярна в конструкциях теплообменников или трубопроводов. Однако медь подвержена кавитационной и эрозийной коррозии. Чтобы предотвратить данную коррозию медь легируют.
В большинстве случаев легирующие элементы придают меди не только более высокую коррозионную стойкость, но и улучшают её механические свойства. Наиболее распространёнными легирующими элементами являются цинк, никель, олово, алюминий и кремний.
Сплавы меди с цинком, при содержании последнего в диапазоне от 15% до 50%, называются латунями. Латунь обладает высокой прочностью, хорошей обрабатываемостью и стойкостью к действию сульфидов. Цинк, будучи более реакционноспособным металлом по сравнению с медью, легко подвергается селективному выщелачиванию. В этом случае на поверхности латуни можно наблюдать отложения меди характерного красного цвета.
Среди прочих сплавов меди особое значение имеет сплав с оловом. Добавка олова значительно повышает предел усталости и в то же самое время позволяет сохранить коррозионную стойкость.
5.4 Коррозия других металлов.
Титан является катодным металлом по отношению большинству прочих металлов и сплавов. На нём легко образуется оксидная плёнка, устойчивая к действию большинства кислот, в том числе соляной. Благодаря сочетанию своих свойств: высокой прочности, низкому удельному весу, высокой коррозионной стойкости, стойкости к высокотемпературному окислению и высокой точке плавления, титан получил применение в самолётостроении.
Никель обладает рядом физических и механических свойств сравнимых с малоуглеродистой сталью. В то же самое время никель обладает более высокой коррозионной стойкостью. В качестве легирующего элемента никель повышает коррозионную стойкость таких металлов, как железо и медь. Чистый никель почти не подвержен контактной коррозии, поскольку благодаря образованию защитной оксидной плёнки является катодом по отношению к большинству металлов. Оксидная плёнка никеля устойчива к действию щелочей.
Кобальт во многих отношениях схож с никелем. В сочетании с хромом кобальт образует сплавы, обладающие превосходной стойкостью к высокотемпературному окислению. Подобно никелю кобальт может быть легко запассивирован, особенно при добавлении в него хрома.
Свинец демонстрирует высокую коррозионную стойкость к серной кислоте. Свинцом покрывают ёмкости и трубы, находящиеся в контакте с этой кислотой. Добавление 3-6% сурьмы повышает механическую прочность свинца. Однако слишком большая доля сурьмы нежелательна, поскольку она ухудшает коррозионные свойства свинца, сурьма легко подвергается действию серной кислоты.
Цинк и его сплавы нельзя применять в коррозионных атмосферах. Этот металл является слишком анодным и не образует практически никакой защитной плёнки.
Почти все благородные металлы демонстрируют высокую коррозионную стойкость в любых кислых и щелочных средах. Серебро и его сплавы растворяются в окисляющих кислотах, но являются устойчивыми по отношению к восстанавливающим. Золото и платина устойчивы к действию даже окисляющих кислот. Они растворимы в так называемой царской водке.
Читайте также статьи
Заказать гальваническое цинкование (Ц.хр)
Сделать заказ цинкования с сертификатом качества на заводе
Техпроцесс и механизм анодирования
Что такое анодирование. Состав и структура оксида. Теория образования пленки.
Неразрушающие методы контроля толщины покрытия
Контроль толщины преобразователями (индукционным и вихретоковым)

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



