
Коррозия алюминия, защищенного химическим никелевым и хромовым покрытием
Содержание:
2. Электрохимические исследования коррозии алюминия с покрытием никель-фосфор и никель-фосфор/хром.
3. ICR, угол смачивания и шероховатость поверхности.
1. Введение.
Вопрос коррозии алюминия с никель-фосфорным химическим покрытием имеет огромное значение в технике. Сам по себе алюминий покрывается трудно и всегда существует риск отслоения покрытия даже со временем. Коррозия под покрытием способна в разы ускорить этот процесс. Механизм коррозии покрытого алюминия сложный и многогранный, чтобы разобраться в нем необходимо использовать электрохимические исследования, электронную микроскопию и рентгено-фазовый анализ. Электрохимические испытания проводились в моделируемых катодных и анодных условиях, имитирующих системы топливных элементов PEMFC (polymer electrolyte membrane fuel cells).
2. Электрохимические исследования коррозии алюминия с покрытием никель-фосфор и никель-фосфор/хром.
2.1 Потенциодинамические условия.
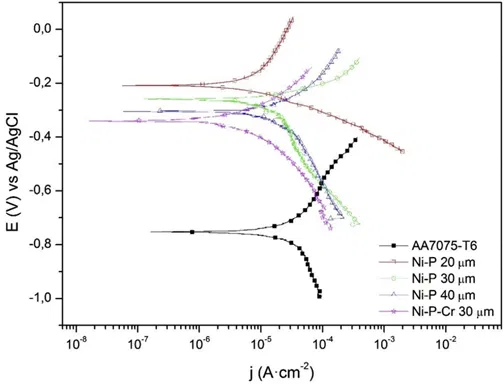
Потенциодинамические коррозионные кривые для Al-подложки с покрытием Ni-P и Ni-P/Cr показаны на рисунке 1.
Условия испытаний:
- Скорость развертки потенциала 0,1 мВ/с;
- Напряжение от -0,4 В до +0,6 В;
- Электрод сравнения: хлорид-серебряный;
- Электролит: H2SO4 с добавкой 0,1 ppm HF;
- pH = 3;
- Температура 80° C;
- Деаэрация электролита гелием (использование кислородосодержащих сред модифицирует катодные наклоны, а на анодные влияют главным образом как состав поверхностного покрытия, так и его морфология).

Рисунок 1 — Потенциодинамические поляризационные кривые для алюминия с покрытием Ni–P 20 мкм, Ni–P 30 мкм, Ni–P 40 мкм и Ni–P 20 мкм + Cr 10 мкм.
Полученные параметры электрохимической коррозии приведены в таблице 1.
|
Образец |
iкорр, μA/см2 |
Eкорр, мВ |
βa, мВ |
βc, мВ |
Rp, Ом*см2 |
|
AA7075-T6 без покрытия |
33,3 |
−741,2 |
259,4 |
−297,2 |
1143,7 |
|
Ni–P 20мкм |
10,6 |
−207,0 |
134,6 |
−306,5 |
3596,9 |
|
Ni–P 30мкм |
20,8 |
−263,7 |
116,2 |
−417,6 |
1352,7 |
|
Ni–P 40мкм |
30,8 |
−298,9 |
319,9 |
−136,2 |
1160,3 |
|
Ni–P/Cr 20+10мкм |
12,2 |
−344,0 |
185,5 |
−272,2 |
4258,6 |
Значения потенциала коррозии Eкорр и плотности тока коррозии iкорр были определены по пересечению линейных участков анодной и катодной кривых Тафеля. Очевидно, что покрытие алюминия сплавом никель-фосфор в любом случае повышает сопротивление изделия к коррозии: потенциалы коррозии Екорр смещаются в сторону более положительных значений, iкорр уменьшается, а Rp увеличивается. При этом защитная способность покрытия в зависимости от толщины имеет точку экстремума (максимум). Это связано с двумя обстоятельствами:
- При слишком низкой толщине покрытие пористо. Общепринято, что чем меньше толщина покрытия, тем больше пористость. Пористость также растет вместе с увеличением шероховатости основы. Граничным значением для химникелевого покрытия на гадких поверхностях является толщина 12-15 мкм, хотя и здесь могут быть единичные поры в районе кромок и мест точечных дефектов основы.
- При слишком высокой толщине покрытия увеличения количество микротрещин, многие из которых могут доходить до основы. Чем больше толщина - тем больше внутренние напряжения в покрытии и тем больше вероятность появления трещин. Кроме этого, большую роль начинает играть разница в коэффициенте теплового расширения (КТР) алюминия и никель-фосфорного сплава, что также способствует растрескиванию толстого покрытия. Аналогичное поведение наблюдается и в двухслойных покрытиях.
Основная задача в защите алюминия от коррозии никель-фосфорным покрытием состоит в том, чтобы добиться условий, когда токи в пассивной области потенциалов от -0.2 до +0.6 В были бы ниже 1 мкА /см2 (по условиям DOE) (рисунок 2).
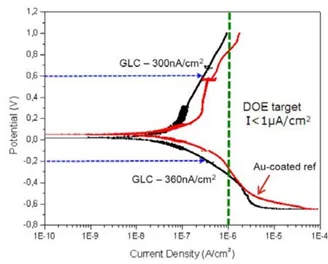
Рисунок 2 — Коррозионные кривые, поясняющие необходимость создания условий со значениями тока коррозии на алюминии ниже 1 мкА /см2 в области потенциалов от -0,2 до +0,6 В.
В случае дополнительной защиты химникеля хромом 10 мкм коррозионная стойкость алюминия немного улучшается, но не настолько, насколько можно было бы ожидать. Проблема здесь также связывается с растрескиванием хрома даже на относительно небольшой его толщине. Что касается значений углов Тафеля, то в целом более высокое значение βa по сравнению с βc наблюдалось для пассивированного материала, тогда как корродированный имел большее значение βc.
2.2 Потенциостатические условия.
Результаты испытаний потенциостатической поляризации в моделированных катодных условиях для общего времени поляризации 5 ч показаны на рисунке 3.
Условия испытаний:
- Напряжение +0,6 В;
- Электрод сравнения: хлорид-серебряный;
- Электролит: H2SO4 + 0,1 ppm HF;
- pH = 3;
- Температура 80° C;
- Аэрация (барботаж воздуха).
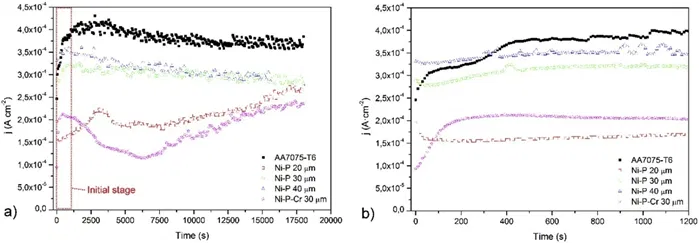
Рисунок 3 — Потенциостатические кривые для чистого алюминия AA7075-T и с покрытием, в моделируемых катодных условиях: а - общие кривые, b - начальный период кривых в увеличении.
Наилучшие характеристики были получены для образца Ni–P 20 мкм + Cr 10 мкм. Максимум плотности тока i достигался на 180°с и имел значение 2*10–4 А/см2. Впоследствии i постепенно уменьшался до минимума 1,14*10–4 А/см2 на 630°с. Когда время испытания дополнительно увеличивается, i также увеличивается, но значения всегда ниже, чем для других образцов.
Образец Ni–P 20 мкм имел аналогичное качественное поведение с максимумом i на 3100с в 2,23*10–4 A/см2, но всегда со значениями i, немного превышающими значения, полученные для образца Ni–P 20 мкм + Cr 10 мкм. После 5 ч потенциостатической поляризации при +0,6 В значения i образцов Ni–P 20 мкм, Ni–P 30 мкм и Ni–P 40 мкм сходились примерно при 2,75*10–4 А/см2. Образец Ni–P 20 мкм + Cr 10 мкм достигал максимума 2,35*10–4 А/см2.
Во всех случаях покрытие сильно повреждалось после 5 ч поляризации, как показано на микроизбражениях в п.2.4.
2.3 Импедансная спектроскопия.
Влияние времени поляризации на характеристики покрытия было изучено с помощью импедансной спектроскопии EIS в смоделированных катодных условиях.
Условия испытаний:
- Напряжение +0,6 В;
- Электрод сравнения: хлорид-серебряный;
- Электролит: H2SO4 + 0,1 ppm HF;
- pH = 3;
- Температура 80° C.
Исследовались наиболее стойкие в моделируемом анодным режиме образцы, т.е Ni-P 20мкм и Ni-P 20 мкм + Cr 10 мкм. Эволюция диаграмм Найквиста для этих образцов как функция времени поляризации показана на рисунке 4.
Общей особенностью диаграмм Найквиста является наличие двух емкостных дуг в диапазоне высоких и низких частот, связанных с двумя постоянными времени. Дело в том, что системе покрытие/алюминий/электролит присутствуют две принципиальных границы, различающиеся по своей площади:
- Граница электролит/покрытие с большой площадью поверхности;
- Граница электролит/подложка, расположенная в областях пор, междоузлий и микротрещин покрытия, с меньшей площадью.
Высокая частотная постоянная связана с откликом на коррозию покрытия, в то время как низкая частота соответствует физико-химическим явлениям, которые одновременно происходят на границе электролит/подложка. Гальванические эффекты, возникающие непосредственно между покрытием и подложкой, влияют на последнее.
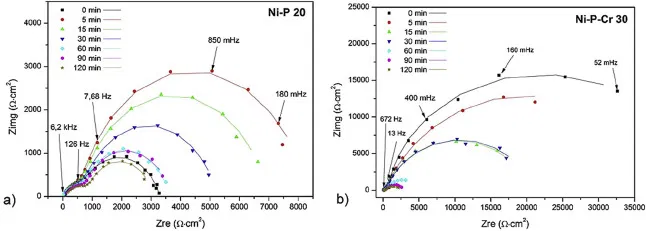
Рисунок 4 — Диаграммы Найквиста для покрытий на алюминии: а) Ni-P 20 мкм и b) Ni-P/Cr 20 + 10 мкм, после потенциостатической поляризации в течение различных времен обработки при +0,6 В. Точки, экспериментальные данные. Линии подгонки сплошные и соответствуют модели подгонки на рисунке 7.
Экспериментальные данные импеданса были обработаны с использованием соотношений Крамерса-Кронига. Результаты, полученные для образца Ni–P 20 мкм, показаны на рисунке 5. Как можно видеть, эти остатки в основном ниже 0,5% вплоть до частот немного выше 1 Гц. Однако, хотя с этой точки спектр показывает некоторый относительный шум, он не показывает значительного смещения между действительной и мнимой составляющими значений импеданса. Качественно аналогичными были результаты, полученные для второго образца. Эти результаты, таким образом, демонстрируют достоверность экспериментальных данных, и для лучшей идентификации каждого отдельного поляризационного процесса распределение времен релаксации (DRT) экспериментальных данных импеданса было рассчитано с помощью DRTtools.
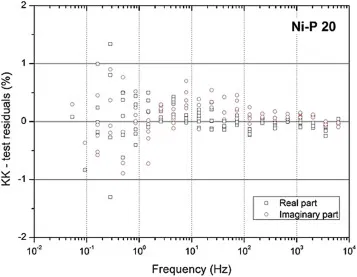
Рисунок 5 — Результаты обработки Крамерса-Кронига экспериментальных данных импеданса по рисунку 4а для покрытия Ni–P 20мкм.
В целом в спектрах EIS можно выделить физико-химические процессы с разными постоянными времени. Однако прояснение отдельных процессов остается неоднозначным, поскольку они имеют тенденцию перекрываться в частотной области. Подход DRT позволяет получить более высокое разрешение в частотной области из данных EIS.
В простейшем случае процесс поляризации в электрической системе можно описать эквивалентной схемой, образованной параллельным соединением омического сопротивления R и емкости C. Эта RC-цепь характеризуется постоянной времени τ = RC. Более сложные механизмы поляризации представлены распределением постоянных времени. Для математического описания этой ситуации вводится функция распределения времен релаксации γ (τ). Каждый процесс определяется распределением постоянных времени с предпочтительной частотой и характерной формой. Площадь, ограниченная пиком, соответствует его поляризационному сопротивлению. Информация, полученная с помощью этого анализа, может быть использована для предложения более последовательных моделей эквивалентных схем электрохимических систем.
Результаты DRT-анализа импедансных спектров из рисунка 4 показаны на рисунке 6.
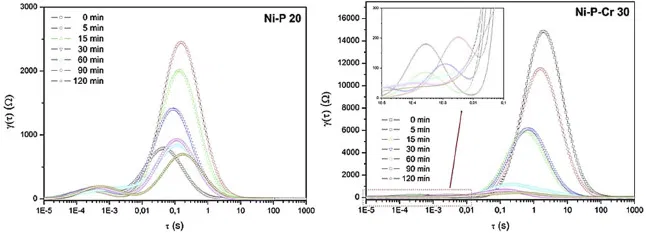
Рисунок 6 — Графики DRT, соответствующие спектрам импеданса из рисунка 4: а) покрытие Ni–P 20 мкм, b) покрытие Ni–P/Cr 20 + 10 мкм.
Для образца Ni–P 20 мкм наблюдаются два четко дифференцированных пика, связанных с двумя различными характерными значениями времени каждого отдельного процесса. Площадь, соответствующая пикам низкого диапазона τ или высокой частоты f, (f = 1 / 2πτ), является функцией времени поляризации. Пик заметно увеличивается в течение первых 5 мин. Впоследствии он постепенно уменьшается при дальнейшем увеличении времени обработки. Однако в образце Ni–P/Cr область, соответствующая пикам в низком диапазоне τ, имеет максимум в начале, постепенно уменьшаясь со временем поляризации. Таким образом, анализ DRT отражает наличие двух постоянных времени, которые связаны с двумя емкостными дугами, которые можно увидеть на диаграмме Найквиста на рисунке 4.
Развитие областей на DRT-диаграммах подтверждает результаты, полученные в потенциостатических поляризационных испытаниях, показанных на рисунке 1, поскольку покрытие Ni–P 20 мкм показывает снижение плотности коррозии в первые минуты обработки, вероятно, из-за закупорки поверхности из-за образования пассивной пленки никеля до того, как межузловые зоны станут затронуты.
С другой стороны, покрытие Ni–P/Cr демонстрирует спонтанную пассивацию с начала обработки из-за присутствия Cr, создавая большую площадь на кривых DRT, связанную с высоким поляризационным сопротивлением покрытия. Эта область показывает прогрессивное уменьшение при увеличении времени обработки, но со значениями выше, чем у сплава Ni–P 20 мкм, за исключением тех, которые соответствуют наибольшему времени обработки, когда покрытие серьезно повреждено.
Физическая модель и связанная с ней электронная схема были предложены для покрытий Ni–P и Ni–P/Cr с учетом диаграмм Найквиста, DRT-анализа спектров импеданса и СЭМ-изображений поверхности (п.2.4) покрытия после поляризационных тестов. Результат показан на рисунке 7. Схема включает сопротивление электролита R1 и две пары R/C элементов, связанных с емкостными дугами высокой и низкой частоты на диаграммах Найквиста. Высокочастотные емкостные компоненты R2*CPE2 связаны со свойствами покрытия, а низкочастотные R3*CPE3 соответствуют процессу переноса заряда на границе раздела подложка/покрытие. Вместо чисто емкостных элементов используются элементы с постоянной фазой CPE2 и CPE3, чтобы представить неидеальное емкостное поведение, связанное с шероховатостью покрытия. Коррозионная стойкость покрытия связана с его поляризационным сопротивлением Rp, рассчитываемым как сумма сопротивлений R2 и R3.
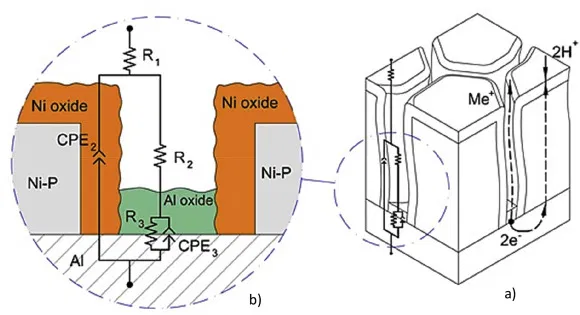
Рисунок 7 — а) Схематическое изображение системы подложка/покрытие/электролит и б) Эквивалентная схема, используемая для корректировки данных EIS на рисунке 4.
В таблице 2 показаны аппроксимирующие значения, полученные для элементов эквивалентной электрической схемы для покрытий Ni–P 20 мкм и Ni-P–Cr 20 + 10 мкм из рисунка 4. При этих значениях были рассчитаны аппроксимирующие линии на рисунке 4. Подгоночные параметры T, P и R каждой пары R/CPE можно использовать для расчета емкостей C2 и C3 из уравнения:
C = R [(1−P)/P]T1/P
|
a) Ni–P 20 мкм
|
|||||||
|
T (мин) |
0 |
5 |
15 |
30 |
60 |
90 |
120 |
|
R1[Ом*см2] |
70,52 |
10,65 |
12,43 |
29,56 |
9,012 |
11,44 |
88,42 |
|
CPE2-T[SP/Ом*см2] |
5,52*10−6 |
1,04*10−5 |
1,08*10−5 |
1,25*10−5 |
9,53*10−6 |
3,70*10−5 |
1,62*10−5 |
|
CPE2-P |
0,762 |
0,695 |
0,688 |
0,654 |
0,678 |
0,498 |
0,607 |
|
R2[Ом*см2] |
764,9 |
935,3 |
930,5 |
1039 |
849,4 |
1279 |
914,4 |
|
C2[F/см2] |
9,89*10−7 |
1,37*10−6 |
1,34*10−6 |
1,25*10−6 |
9,64*10−7 |
1,72*10−6 |
1.06*10−6 |
|
CPE3-T[SP/Ω*см2] |
3,63*10−5 |
1,79*10−5 |
2.20*10−5 |
2,25*10−5 |
3,30*10−5 |
3,00*10−5 |
9,77*10−5 |
|
CPE3-P |
0,739 |
0,860 |
0,841 |
0,831 |
0,801 |
0,926 |
0,811 |
|
R3[Ом*см2] |
2470 |
7451 |
6081 |
4223 |
2801 |
2614 |
2104 |
|
C3[F/см2] |
1,55*10−5 |
1,29*10−5 |
1,50*10−5 |
1,39*10−5 |
1,82*10−5 |
2,45*10−5 |
6.75*10−5 |
|
χ2 |
2,18*10−3 |
1,22*10−3 |
9,48*10−4 |
6,22*10−4 |
1,64*10−3 |
9,14*10−4 |
8,51*10−4 |
|
b) Ni–P/Cr 20 + 10 мкм |
|||||||
|
T (мин) |
0 |
5 |
15 |
30 |
60 |
90 |
120 |
|
R1[Ом*см2] |
54,00 |
50,01 |
49,58 |
94.57 |
60,28 |
52,76 |
50,74 |
|
CPE2-T[SP/Ом*см2] |
1,86*10−5 |
1,25*10−5 |
1,02*10−5 |
1.04 × 10−5 |
2,21*10−5 |
1,19*10−5 |
7,23*10−6 |
|
CPE2-P |
0,593 |
0,703 |
0,719 |
0.697 |
0,538 |
0,601 |
0,649 |
|
R2[Ом*см2] |
1175 |
418,1 |
323,8 |
315.3 |
379,9 |
268,7 |
199,3 |
|
C2[F/см2] |
1,34*10−6 |
1,35*10−6 |
1,10*10−6 |
8.61 × 10−7 |
3,67*10−7 |
2,62*10−7 |
2,08*10−7 |
|
CPE3-T[SP/Ом*см2] |
1,48*10−5 |
2,25*10−5 |
2,40*10−5 |
2.54 × 10−5 |
5,80*10−5 |
8,79*10−5 |
1,26*10−4 |
|
CPE3-P |
1 |
0,759 |
0,766 |
0.758 |
0,678 |
0,657 |
0,589 |
|
R3[Ом*см2] |
46,540 |
39,088 |
20,169 |
20,737 |
5011 |
2557 |
2093 |
|
C3[F/см2] |
1,48*10−5 |
2,17*10−5 |
1.92*10−5 |
2.08 × 10−5 |
3,23*10−5 |
4,03*10−5 |
4,94*10−5 |
|
χ2 |
3,01*10−3 |
2,27*10−3 |
2,95*10−3 |
1.49 × 10−3 |
2,01*10−3 |
9,93*10−4 |
2,16*10−3 |
Экспериментальные значения CPE2-P немного отличаются от идеального емкостного поведения. Эта разница особенно заметна при большом времени обработки, когда покрытие сильно повреждается или отслаивается.
Емкость, связанная с оксидным слоем, может быть выражена как
C = εεoδ
где:
ε - диэлектрическая проницаемость материала;
δ - толщина оксидного слоя;
εo - диэлектрическая проницаемость вакуума = 8,885*10−12 Ф/м.
Учитывая, что величина C2 характеризует толщину поверхностной оксидной пленки, полученные результаты показывают, что ее толщина незначительно увеличивается со временем обработки в обоих покрытиях. Такое поведение сохраняется до 30 мин для покрытия Ni–P 20 мкм и до 60 мин для покрытия Ni–P/Cr 20 + 10 мкм. Это время согласуется с резким изменением значений R3, когда наблюдались значительные визуальные повреждения покрытий, в основном связанные с процессами отслоения. Предлагаемая модель, таким образом, позволит прогнозировать долговечность покрытия в соответствии с полученными результатами значений поляризационного сопротивления.
2.4 Электронная микроскопия до и после коррозии, рентгено-фазовый анализ.
На рисунках 8a и 8b показаны поперечное сечение и морфология поверхности покрытия Ni–P 20 мкм перед коррозионными испытаниями. На поверхности никель-фосфорного покрытия наблюдается морфология клубеньков, похожих на цветную капусту.
Как видно на рисунке 8c и 8d, эта морфология, типичная для химических покрытий Ni–P, обеспечивает преимущественные участки коррозии на узловых границах. Коррозионная стойкость покрытий Ni–P является результатом сочетания принципиально аморфной поверхностной структуры и обогащения поверхности фосфором в результате преимущественного растворения никеля при коррозии.
Эта обогащенная фосфором поверхность реагирует с водой, образуя слой гипофосфитов H2PO2-, который блокирует доступ воды к поверхности металла и предотвращает гидратацию никеля, что считается первым шагом для образования растворимых частиц Ni2+, или пассивной пленки на Ni. Когда же пассивный слой покрытия разрушается, коррозия нарастает, преимущественно вглубь по узловым границам. В конце концов, алюминиевая подложка достигается и покрытие отслаивается. Кроме того, на покрытие также может влиять гальваническая коррозия, связанная с окислительно-восстановительной парой Ni (катод) / Al (анод), ускоряющая процесс разрушения. На изображениях EDX, показанных на рисунке 8e и 8f, Ni и P легко обнаруживаются в зоне с покрытием А1, в областях же отслоения покрытия А2 идентифицируется только Al.

Рисунок 8 — Микроизображения в режиме топографического контраста (SEM) и EDX анализ никель-фосфорного покрытия с толщиной 20 мкм: а) вид поперечного сечения образца перед коррозионными испытаниями, b) морфология поверхности образца перед коррозионными испытаниями, c) и d) морфология поверхности после коррозионных испытаний (5ч поляризации в моделируемых катодных условиях), e) и f) EDX-анализ областей, показанных на виде c.
Как видно на рисунке 9а и 9b, поверхность покрытия Ni–P/Cr 20 мкм + 10 мкм более гладкая, по сравнению с Ni-P 20 мкм, т.е. шероховатость поверхности после хромирования уменьшилась. Сопротивление поляризации для этого покрытия выше и достигает значений 4258,6 Ом*см2, как показано в Таблице 1. Границы раздела между узлами не подвергаются воздействию электролита из-за экранирования хромовым покрытием. Однако, как показано на виде в разрезе на рисунке 9а, в слое хрома после осаждения образуются микротрещины. Они возникают под воздействием внутренних напряжений и иногда достигают никелевой подложки. Как видно на рисунка 9c, именно через эти уязвимые участки электролит проникает к нижележащему слою Ni–P. Как только промежуточная подложка Ni-P достигнута коррозия протекает по тем же механизмам, которые описаны выше. Как видно из изображений EDX на рисунке 9e и 9f, зона неповрежденного покрытия В1 преимущественно состоит из Cr, а поврежденного В2 - из Ni и Cr.

Рисунок 9 — Микроизображения в режиме топографического контраста (SEM) и EDX анализ покрытия Ni-P/Cr 20+10 мкм: а) вид поперечного сечения образца перед коррозионными испытаниями, b) морфология поверхности образца перед коррозионными испытаниями, c) и d) морфология поверхности после коррозионных испытаний (5ч поляризации в моделируемых катодных условиях), e) и f) EDX-анализ областей, показанных на виде c.
3. ICR, угол смачивания и шероховатость поверхности.
Испытания поверхностного сопротивления ICR были выполнены для покрытий до и после того, как они подверглись испытаниям на потенциодинамическую поляризацию в смоделированных анодных условиях. Контактное давление было от 0 до 200 Н/см2.
Было замечено, что для необработанных образцов ICR быстро снижается с увеличением контактного давления от 0 до 60 Н/см2. Дальнейшее увеличение давления от 60 до 100 Н/см2 приводило с умеренному снижению ICR. Когда давление уплотнения превышало 100 Н/см2, ICR оставался практически постоянным. Обработанные образцы демонстрировали аналогичное качественное поведение.
В таблице 3 показаны значения ICR, полученные при эталонном контактном давлении 140 Н/см2. Для покрытия Ni–P 16 мкм на подложке из алюминия AA5251 было получено значение ICR 88,85 мОм*см2, что выше, чем для Ni–P 20 мкм (13,4 мОм см2).
Отметим для справки, что Министерством энергетики США для биполярных пластин PEMFC в 2020 году было установлено целевое значение удельного сопротивления 0,01 Ом*см2.
|
Образец |
ICR (мОм*см2) |
Угол смачивания (°) |
Ra (мкм) |
ΔRa |
|
Ni–P 20мкм |
13,4/15 |
80 ± 4/103 ± 10 |
2,37/2,0 |
−0,37 |
|
Ni–P 30мкм |
45,7/153,5 |
60 ± 4/86 ± 2 |
1,62/1,48 |
−0,14 |
|
Ni–P 40мкм |
45/131 |
70 ± 3/77 ± 4 |
2,0/1,6 |
−0,40 |
|
Ni–P/Cr 20 + 10 мкм |
472,5/629,5 |
77 ± 1/97 ± 2 |
0,83/1,13 |
+0,30 |
ICR металлических материалов определяется как составом поверхности, так и ее морфологией. При том же времени поляризации и применяемом потенциале покрытие Ni–P 20 мкм немного изменяет свое значение ICR, в то время как увеличение значений ICR для покрытий Ni–P 30 мкм и Ni–P 40 мкм является более значительным. Если предположить, что химический состав оксида на поверхности в этих покрытиях примерно одинаков, изменения в значениях ICR после испытаний могут быть связаны с изменениями морфологии поверхности. Это, вероятно, является следствием потери площади поверхностиного контакта из-за локального растворения покрытия в различных областях (см. рисунок 8d).
Однако различия в характеристиках не отражаются в значениях шероховатости, которые показывают некоторые существенные изменения, как видно из Таблицы 3. Образец Ni–P–Cr имеет самые низкие значения шероховатости. Если бы этот параметр был доминирующим фактором, он также должен был бы соответствовать самому низкому ICR. Поверхность, защищенная оксидом хрома, отлично сопротивляется коррозии, о чем свидетельствуют самые высокие значения Rp в таблице 2. Однако в этом случае морфологический фактор не компенсирует высокое сопротивление оксида хрома. Поэтому образец с хромом имеет самые высокие значения ICR.
В таблице 3 также показаны результаты измерений угла смачивания до и после коррозионных испытаний, имитирующих анодные рабочие условия. После коррозионных испытаний краевой угол увеличивается для всех покрытий. Однако наилучшими гидрофобными свойствами обладают покрытия Ni–P 20 мкм и Ni–P–Cr 20 + 10 мкм, поскольку краевой угол смачивания после коррозионных испытаний у них превышает 90°. Кроме этого, значение краевого угла после коррозионных испытаний уменьшается с увеличением толщины покрытия, вероятно, из-за более низкой коррозионной стойкости и большего разрушения покрытия. Этот морфологический эффект отчетливо наблюдается для покрытия Ni–P 20 мкм. Как показано на рисунке 10, при времени обработки 5 и 24 часа гидрофобный характер покрытия теряется из-за коррозионных повреждений.

Рисунок 10 — Эволюция краевого угла смачивания покрытия Ni–P 20 мкм водой в имитируемых катодных условиях: а) до коррозионного испытания, b) 30 мин, c) 5 ч, d) 24 ч.
Читайте также статьи
Техпроцесс химического никелирования.
Описание процесса осаждения химического никелирования. Растворы, структура покрытия.
Техпроцесс гальванического хромирования
Что такое хром? Механизм хромирования. Основные электролиты и режимы процесса.
Заказать гальваническое хромирование (Х.тв)
Сделать заказ хромирования с сертификатом качества на заводе

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



