

Химическое никелирование | Сплав никель-фосфор | Растворы, структура, свойства.
Содержание:
1. Общие требования о химическом никелировании (Ni-P, Хим.Н.)
2. Растворы для химического никелирования и условия проведения процесса.
3. Кинетика процесса химического никелирования.
4. Состав и свойства осадков химического никеля.
1. Общие сведения о химическом никелировании (Ni-P, Хим.Н).
Внешне Ni-Р покрытие имеет желтовато-белый цвет и легкий блеск. Присутствие фосфора в покрытии приводит к заметному отклонению свойств покрытия от чистого никеля. Так, плотность покрытия, в зависимости от содержания фосфора в сплаве, колеблется в пределах от 7,9 до 8,2 г/см3. По электропроводности и магнитным характеристикам сплав Ni-Р уступает чистому Ni тем сильнее, чем выше в нем концентрация Р. Покрытия имеют минимальную пористость и высокие декоративные свойства (особенно при осаждении из свежеприготовленного раствора), поэтому применяются в качестве защитно-декоративных.
Процесс химического никелирования позволяет осаждать покрытия равномерной толщины с отклонениями не более 10% на деталях сложной конфигурации. По сравнению с никелевыми покрытиями, полученными гальваническим способом они обладают более высокой твердостью и износостойкостью, поэтому могут применяться для деталей, работающих в условиях трения, особенно при отсутствии смазки.
|
Обозначение |
Хим.Н Ni-P ENP (Electroless Nickel-Phosphorus) |
|
Толщина |
6-50мкм (возможна и большая толщина) |
|
Микротвердость |
6400 МПа 11000 МПа - в случае термообработки покрытия |
|
Удельное электрическое сопротивление при 18°C |
6,8-10-7 Ом⋅м |
|
Допустимая рабочая температура |
650°C |
|
Коэффициент светоотражения |
75% |
|
Содержание фосфора в сплаве Ni-P |
0-4% (кристаллические покрытия), 4-8% (имеют 2 фазы: кристаллическую и аморфную), 8-14% (аморфные покрытия) |
Высокие защитные свойства наряду с небольшой пористостью позволяют применять никель-фосфорные покрытия в качестве защитных, в том числе в условиях перегретого пара и воздуха, вплоть до 700 °С. Для увеличения износоустойчивости и снижения коэффициента трения никель-фосфорное покрытие наносят на трущиеся поверхности. Незаменимо покрытие в полевых условиях и в небольших мастерских для восстановления размеров изношенных деталей. Целесообразно нанесение покрытия на крупногабаритные детали.
Сцепление никель-фосфорных покрытий сильнее сцепления электролитического никеля, так как осаждение происходит равномерно как внутри, так и снаружи детали, заполняя все микроуглубления и неровности. Отклонения толщин не превышают 10%, поэтому химический никель наносят на прецизионные детали, например на плунжерные пары топливных насосов двигателей, мелкие детали в часовой и оптической промышленности и т.п. Недостатком покрытия является его хрупкость, которая начинает проявляться при толщине слоя около 10 мкм и выше.
Химическое никелирование — автокаталитический топохимический процесс.
Реакция восстановления никеля является автокаталитической, т.е. для ее начала необходимо наличие катализатора на покрываемой поверхности. Каталитическими свойствами обычно обладает металл основы, например железо, титан, алюминий, а в дальнейшем - само никелевое покрытие (отсюда и название "автокаталитический" т.е. никель сам провоцирует свой рост на покрываемой детали).
Наносить химический никель можно и на те металлы, которые не являются катализаторами восстановительной реакции: медь, серебро и др. В этом случае необходим предварительный контакт детали с более отрицательным металлом, например с алюминием, или подача короткого импульса тока.
На свинце, кадмии, олове химникелевое покрытие получить невозможно.
Химический никель наносят и на неметаллические материалы: стекло, керамику и пластмассу. Перед нанесением покрытия поверхность подвергают активированию известными методами.
2. Составы растворов для химического никелирования и условия проведения процесса.
Ход процесса химического никелирования очень сильно зависит от температуры, рН и концентрации компонентов.
- Конкретные условия зависят от типа применяемого раствора.
- Химическое никелирование протекает при рН 4-7 и при рН 8-11, поэтому растворы, в которых происходит осаждение покрытия, делятся на кислые и щелочные.


Кислые растворы по сравнению со щелочными имеют ряд преимуществ: они более стабильны, имеют более высокую скорость осаждения и обладают более высокими защитными свойствами. Кислые растворы используют главным образом при нанесении покрытий на черные и некоторые цветные металлы (медь, латунь, бронза и др.), особенно когда покрытие должно обладать высокой твердостью, износостойкостью и коррозионной устойчивостью. Кислые растворы обеспечивают хорошую скорость металлизации. При рН<3-4 в кислых ваннах процесс осаждения прекращается. При рН>5,5 без лигандов начинается гидролиз солей никеля, при этом частицы гидроксида никеля становятся центрами разложения рабочего раствора и может произойти «саморазряд» ванны - выделение металлического никеля во всем объеме раствора.

Щелочные растворы кроме солей никеля и гипофосфита натрия содержат лиганды - аммиак и лимонную кислоту, что позволяет вести процесс осаждения длительное время. Накапливающийся фосфит не оказывает вредного влияния при концентрации менее 340 г/л.
Щелочные растворы применяют в основном для покрытия металлов, имеющих на своей поверхности оксидную пленку: нержавеющей стали, алюминия, титана и пр. и для металлизации непроводящих материалов. Растворимость фосфитов в щелочных растворах значительно выше, чем в кислых.
- Содержание фосфора в покрытии также зависит от кислотности раствора, снижаясь с понижением рН. Возможно, это связано с тем, что скорость восстановления ионов никеля с ростом рН увеличивается быстрее, чем скорость восстановления фосфора.
- На скорость химического никелирования оказывают влияние температура, концентрация компонентов, соотношение гипофосфита натрия и ионов никеля, природа и количество органических добавок.
- Температуру рабочего раствора поддерживают равной 80-97° С. При повышении температуры с 80 до 90° С скорость осаждения увеличивается в 1,5 раза, а при снижении ее ниже 70° С процесс осаждения полностью прекращается.
Из чего состоит раствор для химического никелирования? (реактивы для никелирования)
• Основным компонентом в составе раствора является соль-носитель ионов никеля. В этом качестве используют либо сульфат в концентрации 0,05-0,1 моль/л , либо хлорид в концентрации 0,15-0,25 моль/л. Увеличение концентрации Ni повышает скорость осаждения покрытия.
• Второй важный компонент — восстановитель, под действием которого будет осаждаться покрытие. Чаще всего побочные продукты работы восстановителя встраиваются в покрытие, образуя сплав: никель-фосфор, никель-бор и пр. Восстановителем обычно служит гипофосфит натрия, что приводит, как уже указывалось, к образованию Ni-P сплава. С ростом концентрации гипофосфита скорость осаждения возрастает, однако сильно повышать концентрацию нецелесообразно, т.к. это может привести к разложению раствора. Чаще всего используют концентрацию гипофосфита в пределах 0,08-0,1 моль/л. Помимо гипофосфита, используют и другие восстановители. Так, с применением борогидрида натрия можно получить Ni-B покрытие, имеющее высокие механические и антикоррозионные свойства.
• Так как во время химического никелирования все время выделяется кислота, необходимо вводить различные буферные добавки. В кислых растворах для поддержания постоянства рН используют ацетат натрия, органические кислоты (молочную, янтарную и пр.), в щелочных — хлорид аммония, аммиак и др. Помимо буферных свойств, некоторые из них сильно влияют на скорость нанесения покрытий. Например, с ростом концентрации CH3COONa от 0 до 20 г/л скорость никелирования меняется от 2 до 10 мкм/ч.
• Введение в раствор комплексообразователей препятствует образованию фосфита никеля, который, выпадая в осадок, делает его непригодным для дальнейшего использования.
• Кроме буферных добавок и комплексообразователей в растворы вводят в очень малых количествах специальные добавки-стабилизаторы. Стабилизаторы — это вещества, предотвращающие спонтанное протекание реакции в объеме раствора, благодаря чему удлиняется его срок службы. Стабилизаторами могут служить сульфид и хромат свинца, тиосульфат натрия, тиомочевина, катионы сурьмы, висмута, мышьяка и др. Их вводят в весьма малых концентрациях (порядка 10-4 - 10-3 г/л). Некоторые из добавок, например, соли свинца, одновременно со стабилизацией раствора улучшают внешний вид осадка. Это, как правило, каталитические яды, которые адсорбируются на образующихся в растворе микрочастицах взвесей и препятствуют их росту. Особенностью действия стабилизирующих добавок является то, что они тормозят образование зародышей металлической фазы на начальной стадии их образования, в особенности в объеме раствора. Стабилизаторами могут являться вещества самой разной природы, соответственно и механизм их действия может быть различным, например, связывание в комплекс или окисление продуктов, выпадающих в осадок. При удачном подборе стабилизаторов они полностью тормозят реакцию в объёме и лишь частично снижают скорость реакции на рабочей поверхности. Наибольшего эффекта добиваются при одновременном использовании нескольких стабилизаторов разного типа.
• В процессе работы ванны в ней копятся фосфиты. Они оказывают решающее негативное влияние на процесс осаждения: взвешенные частицы труднорастворимых фосфитов оседают на деталях, делая поверхность серой и шероховатой.
Химическое никелирование может выполняться в одноразовом и многоразовом растворе:
• В первом случае процесс ведется в ограниченном объеме раствора без корректировки по основным компонентам. В результате их выработки скорость реакции постепенно падает, раствор приходит в негодность. При этом 10-15% исходных компонентов теряется, а буферные добавки пропадают полностью. Для характеристики одноразовых растворов вводят термин “коэффициент использования”, т.е. отношение того количества металла, которое реально осадилось из данного раствора к исходному количеству металла в растворе. До недавнего времени однократная организация процесса использовалась повсеместно.
• Более прогрессивным является непрерывный (многоразоовый) процесс, когда проводится периодическая или непрерывная корректировка раствора по расходуемым реагентам. В этом случае срок службы раствора может быть продлен до нескольких недель, а в идеале - и месяцев.
Скорость осаждения при химическом никелировании колеблется в зависимости от состава электролита составляет от 10 до 25 мкм/ч.
Химическое никелирование проводят в проточных и непроточных растворах. В проточных растворах постоянство состава поддерживается при помощи циркуляции раствора по замкнутому циклу: из реактора, в котором происходит осаждение, в теплообменник, где раствор охлаждается до 55 °С. Затем насосом раствор перекачивается через фильтр, оттуда самотеком стекает в корректировочный бак и возвращается в реактор. Установка снабжается приборами автоматического регулирования рН и температуры.
3. Кинетика процесса химического никелирования.
В ходе химического никелирования зависимость между массой получаемого металла и временем осаждения имеет сложный вид (рисунок 1). После погружения детали в раствор в течение некоторого времени отсутствуют внешние признаки протекания реакции (участок 1). Видимое протекание реакции ХОМ начинается с некоторого момента Τ0.
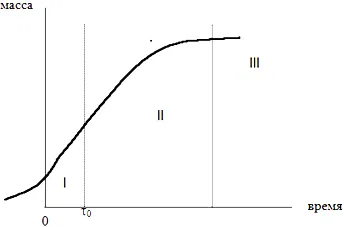
Рисунок 1 — Схематичная зависимость массы осаждаемого никеля при химникелировании от времени.
Кривую можно разбить на несколько участков:
- Индукционный период (I). Отрезок времени между 0 и Τ0. Это время, необходимое для того, чтобы образовались устойчивые малые частицы твердого продукта, обладающие каталитической активностью.
- Период активного роста покрытия (II). После его образования скорость осаждения быстро возрастает.
- Период торможения процесса (III). Объясняется изработкой реагентов в ограниченном объёме раствора. Если проводится периодическая корректировка раствора, торможения может и не быть.
3.1 Кислые растворы.
В настоящее время для описания процесса химического никелирования предложены два основных механизма: химический и электрохимический.
Химический механизм заключается в химическом взаимодействии восстановителя с восстанавливаемым ионом, при котором происходит непосредственный переход электронов от первого ко второму:
• Гипофосфит натрия гидролизуется в воде с образованием фосфита натрия и атомарного водорода по химической реакции:
NaH2PO2 + Н2О = NaH2PO3 + 2Нат.
• Атомарный водород, адсорбированный на поверхности покрываемой детали, восстанавливает ионы никеля по химической реакции:
Ni2+ + 2Нат → Ni + 2Н+
• Одновременно атомарный водород взаимодействует с анионами Н2РО2- и Н2РО3-, восстанавливая фосфор до элементарного состояния, который в последствии входит в состав покрытия.
• При химическом никелировании всегда выделяется водород:
2Нат → H2
На эту реакцию расходуется более 60% выделяющегося по реакции атомарного водорода.
Электрохимический механизм (более вероятный) предполагает протекание на каталитической поверхности отдельных электрохимических реакций (анодного окисления восстановителя и катодного восстановления ионов металла) путем их сопряжения (рисунок 2)
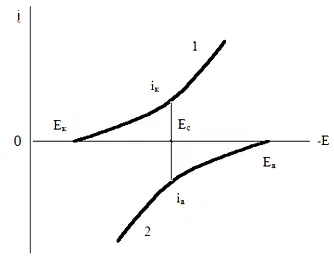
Рисунок 2 — Сопряжение катодного и анодного процессов в ходе химического никелирования: 1 — катодное восстановление металла; 2 — анодное окисление восстановителя; Есм — смешанный потенциал (|ik|=|ia|).
Передача электронов осуществляется с обязательным участием поверхности. Движущей силой процесса является анодное окисление восстановителя, создающее отрицательный потенциал для восстановления ионов металла. Скорость всего процесса определяется способностью данного металла катализировать процесс анодного окисления восстановителя.
При сопряжении катодного и анодного процессов в отсутствие внешнего тока в системе устанавливается стационарное состояние, при котором абсолютные значения катодной и анодной плотности тока равны:
|ik | = |ia |,
ik + ia = 0,
а металл приобретает смешанный потенциал Есм.
Эта плотность тока и определяет скорость реакции химического никелирования. Если скорость процесса, найденная при сопряжении поляризационных кривых, равна реальной скорости металлизации, это служит подтверждением электрохимического механизма процесса. Однако в ряде случаев скорость осаждения металла в модельных системах заметно отличается от реальной, что свидетельствует о частичном или полном протекании процесса по иному механизму.
Весь процесс восстановления никеля гипофосфитом по электрохимическому механизму может быть представлен двумя сопряженными реакциями:
• Анодный процесс окисления гипофосфита:
H2PO2- + 2H2O → H2PO3- + Hадс +H3O+ + e (2)
• Катодный процесс восстановления никеля:
Ni + 2e → Ni (3)
На катоде протекают побочные процессы:
H2PO2- + 2H3O+ +e → P + 4H2O (4)
2H3O+ +2e → H2 + 2H2O (5)
Сопряжение реакций (2) и (3) дает суммарную реакцию окислительно-восстановительного процесса:
Ni2+ + 2H2PO2- + 4H2O → Ni+ 2H2PO3- + H2 + 2H3O+ (6)
Cопряжение реакций (2) и (4) дает реакцию образования фосфора:
2Н2РО2- + Н3О+ → Р + Н2РО3- + Надс + 2Н2О (7)
Сопряжение реакций (2) и (5) – реакцию разложения гипофосфита.
Непосредственное электрохимическое моделирование каталитического процесса показало, что скорость как реакции (2), так и реакции (3) в разделенных системах значительно ниже скорости каталитического восстановления Ni(II) из раствора. Однако при совместном протекании в условиях, при которых проводится никелирование, эти реакции взаимоускоряются, и можно полагать, что каталитический процесс в основном идет путем сопряжения реакций (2) и (3).
Гидрофосфит-ион H2PO32-, образующийся по реакции (2), (7), (в кислой среде реакция идет с образованием фосфит-иона РО32-), реагируя с ионами Ni2+, образует нерастворимый осадок, что ухудшает качество покрытия и ведет к разложению раствора. Для предотвращения выпадения фосфита никеля в раствор вводят лиганды, например, цитрат натрия, глицин, соли аминокислот – в кислые растворы, хлорид аммония, пирофосфат натрия – в щелочные.
3.2 Особеннсти химического никелирования из щелочных растворов.
На рисунке 3а и 3б приведена диаграмма Е-рН (Е - окислительно-восстановительный потенциал системы). Линии на диаграмме отражают равновесия определенных ОВ реакций в зависимости от рН раствора. На диаграмму нанесены состояния никеля (рисунок 3а), цитратного комплекса никеля (рисунок 3б) и гипофосфита, отвечающие равновесным реакциям, приведенным в таблице 2.
На рисунке 3 заштрихована область — это область, где никель находится в восстановленном (металлическом) состоянии, в гипофосфит — в окисленном, т. е. область возможного протекания реакций химического восстановления. Сравнение рисунков показывает, что в присутствии лиганда (цитрат-иона) исчезают оксидные соединения никеля, а область протекания реакции заметно расширяется как по потенциалам, так и по интервалам рН.
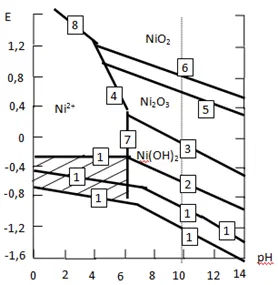
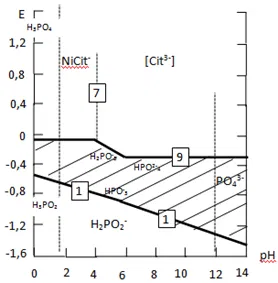
a б
Рисунок 3 — Диаграмма Е-рН: а - для системы никель - вода, гипофосфит-вода, б - для системы никель - вода, цитратный комплекс никеля - вода, гипофосфит-вода. Номера кривых на диаграмме соответствуют номерам равновесий в табл. 2 состояния никеля (1 - 9) и состояния гипофосфита (10-14).
|
№ |
Равновесие |
Уравнение, описывающее равновесие |
|
1 |
Ni2+ + 2e + Ni |
E = -0,250 + 0,0295lg[Ni2+] |
|
2 |
Ni(OH)2 + 2H+ + 2e = Ni + 2H2O |
E = 0,110-0,059lgpH |
|
3 |
Ni3O4 + 2H2O + 2H+ + 2e = 3Ni(OH)2 |
E = 0,897-0,059lgpH |
|
4 |
Ni3O4 + H+ + 2e = 3Ni2+ + 4H2O |
E = 1,977-0,264pH - 0,08861lg[Ni2+] |
|
5 |
2Ni2O3 + 2H+ + 2e = 2Ni3O4 + H2O |
E = 1,305 - 0,059 pH |
|
6 |
2NiO2 + 2H+ + 2e = Ni2O3 + H2O |
E = 1,434 - 0,059 pH |
|
7 |
Ni(OH)2 + 2H+ = Ni2++ 2H2O |
lg[Ni2+] = 12,18 - 2 pH |
|
8 |
NiO2 + 4H+ + 2e = Ni2+ + 2H2O |
E = 1,593-0,118pH - 0,0295lg[Ni2+] |
|
9 |
[NiCit]-+ 2e = Ni + Cit3- |
E = -0,37 + 0,295lg[NiCit-/Cit3-] |
|
10 |
H2PO3- + 2H+ + 2e = H2PO2- + H2O |
E = -0,31 - 0,059 pH |
|
11 |
HPO32- + 3H+ + 2e = H2PO3- + H2O |
E = -0,276 - 0,87 pH |
|
12 |
H2PO4- + 2H+ + 2e = H2PO3- + H2O |
E = -0,26-0,059pH + 0,0295lg[H2PO4-]/ [H2PO3-] |
|
13 |
HPO42- + 2H+ + 2e = HPO32- + H2O |
E = 0,234 - 0,059pH + 0,0295lg [HPO42-]/ [HPO32-] |
|
14 |
PO43- + 2H2O + 2e = HPO32- + 3OH- |
E = 0,14 - 0,087pH |
4. Состав и свойства осадков химического никеля.
Покрытия, полученные при химическом никелировании, имеют слоистую аморфную структуру. Содержание фосфора в покрытии 3-8% для щелочных и 8-10 % для кислых растворов. С ростом кислотности раствора содержание Р в осадке возрастает. Иногда можно получать осадки с содержанием фосфора до 15%.
Термообработка сильно меняет свойства осадка. На стальных деталей она производится при температуре 300-400 °С, алюминиевых — при 275-280 °С, а деталей из дюраля — при 375-385 °С. Время выдержки во всех случаях 1 ч. Структурные превращения в покрытиях сопровождаются выделением тепла и изменением объема, поэтому при очень быстром нагреве возможно разрушение покрытий.
В каждом конкретном случае с учетом содержания фосфора в покрытии и путем подбора режима термообработки можно добиться заданных характеристик покрытия - механических, защитных, антифрикционных. Таким образом, осаждение сплава Ni-Р позволяет создать широкий спектр функциональных покрытий при хороших антифрикционных свойствах, что невозможно при осаждении чистого никеля.

Исходное Ni-Р покрытие имеет слоистую структуру. При этом в осадке возникают внутренние напряжения, что приводит к повышенной хрупкости покрытия и, иногда, его недостаточному сцеплению с основой. Термообработка при 500-600° С полностью устраняет слоистость. Внутренние напряжения в покрытии резко снижаются. Одновременно повышается пластичность осадка, снижается хрупкость, улучшается его сцепление с основой. Это связано с образованием равномерной мелкокристаллической структуры, удалением частиц газа из приграничного слоя и заполнением появившихся пустот частицами металла.
Микроизображение химического никелевого покрытия с толщиной 20 мкм, осажденное на алюминиевую подложку, приведено на рисунке 4.

Рисунок 4 — Микроизображение химического никелевого покрытия на алюминии, полученное в режиме топографического контраста.
Одна из важнейших эксплуатационных характеристик Ni-Р покрытий - микротвердость. В свежеосажденном покрытии она превышает микротвердость чистого никеля в 1,5-2 раза и составляет 4500-5000 МПа. Термическая обработка позволяет повысить микротвердость покрытий до 8400-11800 МПа. Подобным же образом термообработка может улучшить и другие механические характеристики - предел прочности, антифрикционные свойства и др., а также снизить пористость осадка, т.е. улучшить защитные характеристики.
Свежеосажденный сплав представляет собой твердый раствор замещения Р в гексагональном a-Ni с сильным искажением периодичности решетки. В результате нагрева происходит распад твердого раствора с образованием равновесной двухфазной эвтектической системы, состоящей из Ni с небольшим содержанием фосфора и интерметаллического соединения фосфида Ni3Р.
Рентгенограммы покрытий Ni-P с содержанием фосфора 10-12 %масс. представлены на рисунке 5.
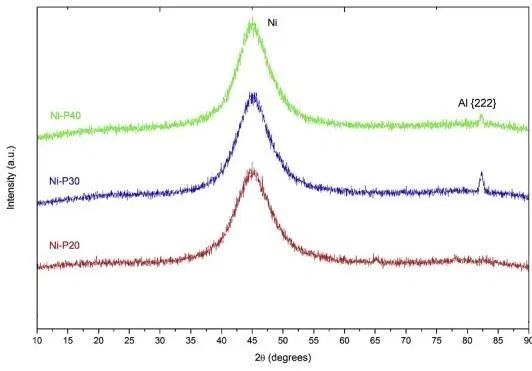
Рисунок 5 — Рентгенограммы покрытий Ni-P с содержанием фосфора 10-12 %масс. Толщина покрытия 20, 30, 40 мкм.
В случае образцов с толщиной 20, 30 и 40 мкм на рентгенограммах обнаруживается широкий пик на угле 2θ = 45,11°. Этот пик характерен для химического никель-фосфорного покрытия с содержанием фосфора >7%. Средние размеры кристаллов в таких покрытиях, рассчитанные по уравнению Шеррера при 2θ = 45,11°, меньше 2 нм. В этих условиях образцы не имеют достаточного количества унитарных клеточных повторений, чтобы рассматриваться как кристаллические материалы. Поэтому покрытия Ni-P - нанокристаллические образования.
Аналогичные результаты описаны в литературе для покрытий с содержанием фосфора более 10%. Так, имеются сведения, что химические покрытия Ni-P на Al-подложках, имеют нанокристаллическую структуру с кристаллитами 1,5 нм при содержании фосфора 10,2 %масс. и 10,03 %масс.
При снижении содержания Р ниже 7% или термообработке сплавов выше 350° С наблюдается значительное усиление отражения при 2θ = 45,11°, что свидетельствует о переходе структуры химникеля из нанокристаллической в кристаллическую. В этом переходе рентгенограммы выявили набор текстур, соответствующих гранецентрированной кубической решетке никеля, то есть плоскостям отражения Ni{111}, Ni{200} и Ni{220}, а также фазе Ni3P. Ширина пика при 2θ = 45,11° может быть связана с отражением Ni{111} (ICDD № 01-087-0712), таким образом, нанокристаллы могут быть текстурированы в {111}. Этот факт можно было бы подтвердить, подвергнув покрытие термообработке при 400° С и проверив появление других пиков при 2θ = 51,8° и 76,38°, соответствующих отражениям {200} и {220} соответственно (ICDD № 01-087-0712).
После проведении коррозионных испытаний (80° С) алюминия с химникелевым покрытием микроструктурных изменений в покрытии не обнаруживалось.
Читайте также статьи
Гальваническое никелирование
Описание процесса осаждения гальванического никеля. Свойства покрытия.
Никелирование узких труб
Проблемы при нанесении покрытий на узкие трубы
Заказать гальваническое никелирование (Н.б)
Сделать заказ никелирования с сертификатом качества на заводе

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



