

Механизм и технологический процесс анодирования титана
1. Общие сведения о титане и его сплавах.
1.1 Свойства титана и его сплавов.
Титан – современный легкий, прочный и коррозионно-стойкий конструкционный материал. Относится к переходным металлам. Он устойчив во многих средах, при комнатной температуре, на воздухе - до 550 °C. Стойкость титана обусловлена присутствием на поверхности тонкой, но плотной оксидной пленки. Толщина ее достигает 5-20 нм, что чуть больше, чем на алюминии, но на титане она гораздо прочнее. Естественная пленка на титане преимущественно состоит из рутила и анатаза. При температуре выше 600 °C титан активно реагирует с кислородом с образованием чистого рутила.
Титан имеет две аллотропные модификации:
- низкотемпературную α-модификацию (α-Ti) с гексагональной элементарной ячейкой (а = 0.295 нм, с = 0.468 нм, с/а = 1.587).
- высокотемпературную β-модификацию (β-Ti) с объемоцентрированной кубической ячейкой (а = 0.332 нм), стабильную от 882 °C до температуры плавления 1672 °C.
На механические свойства титана влияет наличие таких примесей как O, N и C, которые повышают прочность при значительном снижении пластичности и коррозионной стойкости. Несмотря на высокую температуру плавления титан не является жаростойким, так как при повышении температуры до 250 °C сопротивление на разрыв уменьшается почти вдвое, при температуре выше 500 °C увеличивается в 1.5-2 раза скорость окисления, а при 500-700 °C начинается поглощение азота, угарного и углекислого газа. При низких температурах 50-70 °C титан адсорбирует водород, что свидетельствует о склонности к водородному охрупчиванию.
Недостатками чистого Ti также являются низкий модуль упругости, склонность к ползучести уже при комнатной температуре, плохая обрабатываемость резанием. Функциональность Ti можно повысить легированием или с помощью термической обработки.
Достоинством титановых сплавов по сравнению с чистым титаном являются более высокие прочность и жаропрочность при достаточно хорошей пластичности, высокой коррозионной стойкости и малой плотности. В зависимости от влияния на температуру перехода α-Ti в β-Ti, легирующие титан элементы делятся на нейтральные (Sn и Zr), α- и β-стабилизаторы. α-стабилизаторы увеличивают температуру перехода, в то время как при β-стабилизации происходит ее уменьшение. Среди α-стабилизаторов самым распространенным является алюминий, поскольку он повышает удельную прочность сплавов при сохранении пластичности, приводит к увеличению модуля упругости, а также уменьшает плотность и склонность к водородной хрупкости, что является основным недостатоком титановых сплавов. Кислород, азот и углерод также принадлежат к данной категории.
Самой распространенной классификацией титановых сплавов является классификация по фазовому составу. Согласно ей выделяют: α-сплавы, псевдо α-сплавы (α-фаза + β-фаза до 5% или интерметаллиды), (α+β)-сплавы, псевдо β-сплавы (структура представляет собой в основном β-фазу, а после термической обработки - α-фаза + β-фаза в небольшом количестве), β-сплавы. Необходимо добавить также сплавы на основе интерметаллидов, например, Ti3Al, TiAl, Ti3Al, обладающих повышенной химической стойкостью, твердостью, жаропрочностью.
| Марка сплава | Содержание металлов в сплаве, % | |||||||||
| Титан, Ti | Алюминий, A | Марганец, Mn | Вольфрам, W | Молибден, Mo | Ниобий, Nb | Ванадий, Va | Цирконий, Zn | Хром, Cr | Олово, Sn | |
| ВТ 1-00 | 99,05 | |||||||||
| ВТ 1-0 | 98,28 | |||||||||
| ОТ 4-0 | 96,018 | 1,4 | 1,3 | |||||||
| ОТ 4-1 | 94,168 | 2,6 | 2 | |||||||
| ОТ 4 | 91,668 | 6 | 2 | |||||||
| ВТ 6 | 86,585 | 6,8 | 5,3 | |||||||
| ВТ 5-1 | 88,665 | 6 | ||||||||
| ВТ 5 | 90,416 | 6,2 | ||||||||
| ВТ 6С | 87,716 | 6,5 | 4,5 | |||||||
| ВТ 3-1 | 85,785 | 7 | 3 | 2 | ||||||
| ВТ 8 | 87,385 | 7 | 3,8 | |||||||
| ВТ 9 | 85,986 | 7 | 3,8 | 2 | ||||||
| ВТ 14 | 86,685 | 6,3 | 3,8 | 1,9 | ||||||
| ВТ 15 | 74,368 | 3,6 | 8 | 11,5 | ||||||
| ВТ 16 | 84,385 | 3,8 | 5,5 | 5 | ||||||
| ВТ 18 | 84,465 | 8,2 | 1 | 1,5 | 1,8 | |||||
| ВТ 20 | 84,985 | 7 | 2 | 2,5 | 2,5 | |||||
| ВТ 22 | 79,206 | 5,7 | 5,5 | 5,5 | 1,5 | |||||
| ВТ 25 | 82,595 | 7,2 | 0,5-1,5 | 2,5 | 2,5 | 2 | ||||
| ВТ 18у | 81,665 | 7,3 | 1 | 1,5 | 4,5 | |||||
| ПТ 3В | 91,232 | 6 | 2,5 | |||||||
| ПТ 7М | 93,534 | 2,5 | 3 | |||||||
| 19 | 86,414 | 6,5 | 4 | 2,5 | ||||||
| 14 | 87,734 | 5,6 | 3,5 | 2,5 | ||||||
| 28 | 94,944 | 2,5 | 2 | |||||||
| 40 | 94,374 | 3,6 | 1,6 | |||||||
| 3М | 94,334 | 6 | ||||||||
| 17 | 84,164 | 6,5 | 2,2 | 6,5 | ||||||
1.2 Области применения титана и его сплавов.
- Сплавы титана используются в ракетно-космической и авиационной технике, в судостроении и транспортном машиностроении. Прежде всего - по причине их жаропрочности (не путать с жаростойкостью), т.е. высокой механической прочности при повышенных температурах, и превосходной устойчивости к коррозии.
- Благодаря пластичности и вязкости при низких температурах титановые сплавы начинают применяться в холодильной и криогенной технике.
- Титан используется в медицине благодаря высокой устойчивости в тканях человеческого организма. В частности, легированные сплавы на основе титана с небольшим содержанием алюминия, ниобия или ванадия (Ti6Al7Nb – IMI 367, Великобритания, TC20 – Китай, Ti6Al4V – IMI 318, Великобритания, Ti-64 - США, ВТ6 - Россия) применяются для изготовления имплантов, особенно для замены тазобедренных суставов. Ti6Al7Nb - α+β титановый сплав с хорошей устойчивостью к коррозии, клинически используемый с 1986 г., полученный в качестве замены Ti6Al4V. Как и у всех сплавов титана, его биологическая совместимость главным образом связана с тонким оксидным слоем, который естественным образом покрывает его поверхность. Помимо диоксида титана TiO2 пассивная пленка содержит оксиды легирующих элементов (Al и Nb), в данном случае Al2O3 и Nb2O5. Установлено, что сплав Ti6Al7Nb обладает лучшей биологической совместимостью, чем Ti6Al4V, благодаря формированию на поверхности оксида ниобия Nb2O5, который химически более устойчив и менее подвержен разрушению, а также нетоксичен в отличие от V2O5.
2. Структура анодированного титана.
При взаимодействии титана и кислорода может быть образовано до 15 оксидных соединений с различными свойствами. Наибольший интерес вызывает диоксид титана, а также ряд так называемых фаз Магнели. Для TiO2 имеется три кристаллических модификации: анатаз (а-TiO2), рутил (р-TiO2) и брукит (рисунок 1 а-в), структура которых представляет собой комбинации, составленные из искаженных октаэдров TiO6.
, rutila (b) i brukita (v).jpg)
Рисунок 1 - Кристаллические структуры анатаза (а), рутила (б) и брукита (в).
Нагревание TiO2 приводит к уходу кислорода с образованием Ti3O5, а затем Ti2O3 и TiO, которые, как правило, имеют черный (темно-фиолетовый, темно-синий) цвет, а значит, способны поглощать свет и проявлять фотокаталитическую активность в видимой области. Монооксид титана TiO имеет структуру типа NaCl (рисунок 2 а), Ti2O3- кристаллическую решетку типа корунда α-Al2O3 (рисунок 2, б). Брукит редко исследуется, так как трудно синтезируется в лабораторных условиях. При нагревании анатаз необратимо превращается в рутил, температура такого перехода колеблется в интервале Т=673-1473 K в зависимости от условий термического воздействия. Отличия в кристаллической структуре обуславливают разные физические свойства рутила и анатаза, например, величину ширины запрещенной зоны, составляющую Eg = 3.2 эВ для а-TiO2, Eg = 3.0 эВ для р-TiO2, а у аморфного TiO2 – Eg = 3.2-3.5 эВ. В соответствии со значениями Eg, как анатаз, так и рутил относят к широкозонным полупроводникам.
, i TiO (b)..jpg)
Рисунок 2 - Кристаллические структуры Ti2O3 (а), и TiO (б).
Повысить толщину и плотность естественной оксидной пленки на титане можно путем анодирования (анодного оксидирования). После анодирования можно также добиться повышения микротвердости поверхности титана, износостойкости, жаростойкости, жаропрочности, усталостной прочности и стойкости к схватыванию. После анодирования повышаются антифрикционные свойства поверхности деталей, предотвращается контактная коррозия при соприкосновении титана с алюминием, магнием, кадмиевыми и цинковыми покрытиями. Также анодная плёнка, благодаря пористой структуре, хорошо зарекомендовала себя как подслой для нанесения лакокрасочных материалов, клеев, герметиков, смазок. Высокая коррозионная стойкость в физиологической среде анодированного титана позволяет использовать данный материал для производства имплантов и протезов.
Анодирование титана исследуется достаточно давно. На первом этапе особенное внимание уделялось изучению процесса формирования оксидных пленок барьерного типа в слабых водных растворах H2SO4, Na2SO4, HNO3. Малая толщина (не более 40-50 нм) и неоднородное аморфно-кристаллическое строение барьерных анодных оксидов титана заметно ограничивали их применение, в частности, как диэлектрических слоев.
Начиная с 1999 г. изучается электрохимическое анодирование титана в различных фторсодержащих электролитах с целью создания нанотрубчатых оксидных пленок (НТАОТ). Было предложено несколько групп фторсодержащих электролитов:
- водные растворы плавиковой кислоты;
- водные растворы серной и фосфорной кислот с добавкой фторсодержащих компонентов;
- органические электролиты на основе этиленгликоля, глицерина, их сложных композиций с добавкой плавиковой кислоты или других соединений фтора, чаще всего NH4F.
- водные растворы, в которых присутствуют ионы хлора, а также как водные, так и безводные электролиты с нитратсодержащей добавкой.
На рисунке 3 показана схематичная структура идеального аноднооксидного покрытия на титане. Как и для анодированного алюминия, реальная структура оксида получается искаженной, если процесс проводился не в контролируемых условиях получения идеальных нанотрубок.
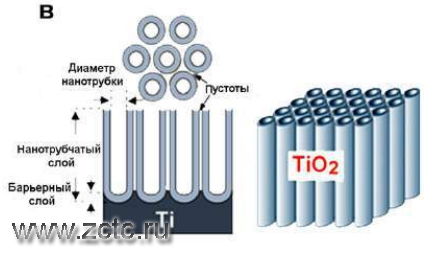
Рисунок 3 – Идеальная схема анодно-оксидного покрытия на титане.
Исследования, выполненные методом электронной микроскопии, выявили, что поверхность анодно-оксидного покрытия имеет развитую ячеистую структуру. Покрытие пористое, но поры не достигают поверхности металла. Диаметр пор составляет от 100 до 500 нм. На размер пор влияет способ получения, состав электролита и технологические режимы процесса. Толщина покрытия ограничена ввиду высоких электроизоляционных свойств TiO2 который имеет большее электрическое сопротивление, чем электролит, и препятствуют прохождению тока. В этот момент происходит разогрев в приграничной зоне и начинает преобладать химическая реакция, оксиды растворяются в электролите.
Ниже представлено разнообразие структур анодных оксидов титана, полученных в различных условиях: разные электролиты, разное время проведения процесса, наличие термообработки.

Рисунок 4 - СЭМ-изображения поверхности анодных неструктурированных анодных оксидов на титане, сформированных анодированием в 10% H2SO4+0.15 % HF, Ua=20В, ta=20 мин.

Рисунок 5 - СЭМ-изображения поверхности трубчатого слоя и поперечного сечения НТАОТ, сформированных в водном растворе 0.5% HF при 20В в течение 20 мин.
 i bar'ernogo (v) sloev i poperechnogo secheniya (b) NTAOT, sformirovannoj v vodnom rastvore.jpg)
Рисунок 6 - СЭМ-изображения поверхности пористого (а) и барьерного (в) слоев и поперечного сечения (б) НТАОТ, сформированной в водном растворе 1M (NH4)2SO4+ 0.5% NH4F.
, trubchatogo (b) sloev, a takzhe poperechnoe sechenie (v) NTAOT, sformirovannogo v etilenglikole s dobavkoj.jpg)
Рисунок 7 - СЭМ-изображения, характеризующие морфологию поверхности барьерного (а), трубчатого (б) слоев, а также поперечное сечение (в) НТАОТ, сформированного в этиленгликоле с добавкой 0.3% NH4F + 2% H2O при 60В в течение 6 ч.
 i poperechnogo sloma (b) NTAOT tolshchinoj 40 mkm, sformirovannogo dolgovremennym anodirovaniem v techenie.jpg)
Рисунок 8 - СЭМ-изображения поверхности трубчатого слоя (а) и поперечного слома (б) НТАОТ толщиной 40 мкм, сформированного долговременным анодированием в течение 23 ч в C2H4(OH)2+0.25%NH4F.

Рисунок 9 - СЭМ-изображение поверхности пористого слоя оксидов, полученных двухступенчатым анодированием в C2H4(OH)2+0.25%NH4F и (б) Al в 3% C2H2O4.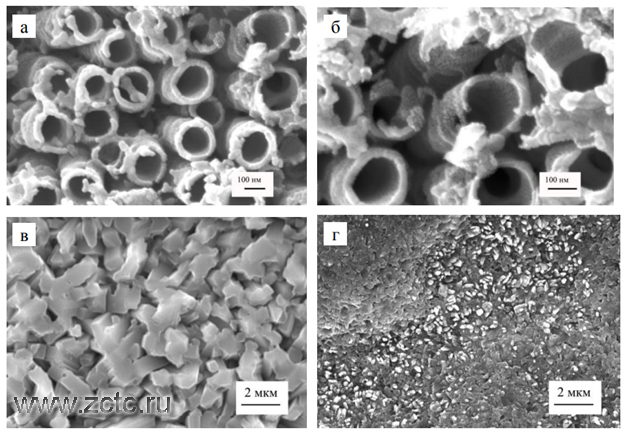
Рисунок 10 - СЭМ-изображения поверхности НТАОТ, сформированного одноступенчатым анодированием в C2H4(OH)2+0.25%NH4F, после отжига в атмосфере при 600 °С(а, б), а также после отжига при 1093 K в атмосфере (в) и в вакууме (г).

Рисунок 11 - СЭМ-изображения поверхности и поперечного сечения НТАОТ, сформированных в хлорсодержащих электролитах: (а) 0.5М муравьиная кислота + 0.4M NH4Cl; (б) 0.5М глюконовая кислота + 0.4M NH4Cl.
3. Технология и электролиты для анодирования титана
Процесс анодирования деталей из титановых сплавов заключается в погружении детали в электролит и соединение её с положительным полюсом источника постоянного тока. Минус идет на катоды. Во время прохождения электрического тока через электролит, на аноде в активной форме выделяется кислород, который взаимодействует с титаном образуя анодно-оксидную пленку. Нарастание анодного слоя происходит не на внешней поверхности детали, а под слоем ранее образовавшейся окисной плёнки, то есть на границе титана с анодной плёнкой.
Технологический процесс оксидирования в промышленных условиях обычно состоит из следующих этапов:
- Монтаж обрабатываемых деталей на приспособления для анодирования.
- Химическое обезжиривание деталей (в соответствии с производственной инструкцией).
- Промывка в горячей (40-50 градусов) проточной воде многократным окунанием.
- Промывка в холодной проточной воде многократным окунанием.
- Травление в смеси кислот HNO3 44% и HF 10%.
- Промывка в холодной проточной воде многократным окунанием.
- Непосредственно анодирование.
- Промывка в холодной проточной воде многократным окунанием.
- Сушка.
- Демонтаж изделий с приспособлений для анодирования.
- Контроль результата с помощью осмотра и проверки толщины анодного покрытия (до 5 мкм — оценкой напряжения пробоя, выше — с помощью толщиномера).
4.1 Анодирование титана в сернокислом электролите
Состав электролита:
Кислота серная от 50 до 60 г/л для сплавов ВТ-1, ВТ-3, ВТ-4,ОТ-4, ВТ-5, ОТЧ
Температура электролита от 15 до 25 °С
Может выполняться в двух режимах:
- Анодирование в стационарном режиме в сернокислотной ванне. Обработку проводят при поддерживании постоянной плотности тока 1-1,5 А/дм2 увеличением напряжения от 5 до 25 В. Толщина получаемого покрытия составляет от 6 до 12 мкм.
- Анодирование в импульсном режиме в сернокислотной ванне. Источник постоянного тока выдаёт кратковременные импульсы длиной в 0,1–0,3 сек. с частотой 120 импульсов в минуту, превышающие рабочий ток в 5–8 раз. Для получения плёнки 15-20 мкм необходим источник тока, позволяющий выдавать плотность тока до 50 А/дм2. В конце процесса напряжение возрастает до 250 В. Необходимо охлаждение ванны. В данном процессе происходит послойное уплотнение плёнки, поэтому плёнки обладают малой пористостью. Покрытия, полученные при анодировании титана из сернокислого электролита имеют удельное электрическое сопротивление σ = 3,7·10-8 Ом/см.
4.2 Анодирование в фосфорной кислоте
Состав электролита:
Кислота ортофосфорная 50-100 г/л
Температура электролита 15-25 °С.
Выполняется в фосфорнокислом электролите, при низких плотностях тока от 0,2 до 0,8 А/дм2 и напряжении от 50 до 150 В.
Цветное декоративное анодирование титановых сплавов позволяет получать непосредственно в процессе электролиза, без применения красителей, цветные окисные пленки толщиной до 10 мкм, относящиеся по своей природе к интерференционно – окрашенным.
Цвет пленки зависит от приложенного напряжения на ванне и марки исходного сплава, что продемонстрировано в таблицах 1 и 2.
Декоративное анодирование титановых сплавов позволяет получить коричнево-желтые, синие, голубые, желтые, розовые, малиновые, зеленые цвета и оттенки поверхности.
| Напряжение, В | Группы декоративности титановых сплавов | |||
| 1 | 2 | 3 | 4 | |
|
ВТ20, ВТ6 |
ВТ14, ВТ15, ВТ16, ВТ3-1, 4201 |
ВТ1-0, ВТ5-1 |
ОТ4, ОТ4-1 |
|
| 8 | Светло-коричневый | Светло-коричневый | Светло-коричневый | Светло-коричневый |
| 10 | Коричневый | Коричневый | Коричневый | Коричневый |
| 12 | Темно-коричневый | Темно-коричневый | Темно-коричневый | Темно-коричневый |
| 15 | Лиловый | Лиловый | Лиловый | |
| 20 | Темно-синий | Темно-синий | Темно-синий | |
| 25 | Синий | Синий | Синий | |
| 30 | Голубой | Голубой | Голубой | |
| 35 | Светло-голубой | Светло-голубой | Светло-голубой | |
| 40 | Светло-салатовый | Светло-салатовый | Светло-салатовый | |
| 45 | Светло-желтый | |||
| 50 | Желтый | |||
| 55 | Розовый | |||
| 60 | Светло-малиновый | |||
| Напряжение, В | Группы декоративности титановых сплавов | |||
| 1 | 2 | 3 | 4 | |
|
ВТ20, ВТ6 |
ВТ14, ВТ15, ВТ16, ВТ3-1, 4201 |
ВТ1-0, ВТ5-1 |
ОТ4, ОТ4-1 |
|
| 8 | Светло-коричневый | Светло-коричневый | Светло-коричневый | Светло-коричневый |
| 10 | Коричневый | Коричневый | Коричневый | Коричневый |
| 12 | Темно-коричневый | Лиловый | Лиловый | Лиловый |
| 15 | Лиловый | Темно-синий | Синий | Темно-синий |
| 20 | Темно-синий | Синий | Светло-синий | Синий |
| 25 | Синий | Темно-голубой | Голубой | Голубой |
| 30 | Голубой | Голубой | Бледно-желтый | Светло-голубой |
| 35 | Светло-голубой | Светло-голубой | Светло-желтый | |
| 40 | Слабо выраженный светлозеленый | Слабо выраженный светлозеленый | Желтый | |
| 45 | Светло-желтый | Светло-желтый | ||
| 50 | Желтый | Желтый | ||
| 55 | Желто-розовый | Желто-розовый | ||
| 60 | Светло-розовый | Светло-розовый | ||
| 65 | Розовый | Розовый | ||
| 70 | Розово-малиновый | Розово-малиновый | ||
| 75 | Малиново-фиолетовый | Темно-бирюзовый | ||
| 80 | Бирюзовый | Зеленовато-желтый | ||
| 85 | Зеленый | |||
| 87 | Желто-зеленый | |||
Визуально пример градиента цвета анодированного титана в зависимости от напряжения на ванне показан на рисунке 12.
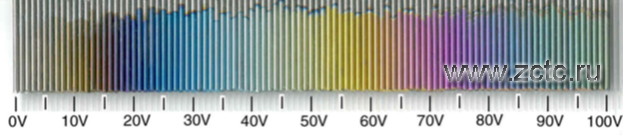
Рисунок 12 – Градиент цвета покрытия на титане при анодировании в зависимости от напряжения.
Изменение цвета связано с различиями в кристаллической структуре анодного слоя. Толщина анодного слоя влияет на попадающий в слой свет, который преломляется под разными углами, при этом немного изменяется цвет пленки. Это отличает его от анодированного алюминия, в котором используются красители и цвет не зависит от угла обзора.
Цветное анодирование титановых сплавов используется для декоративной отделки и маркировки. Декоративное анодирование увеличивает коррозионную стойкость изделий и обеспечивает высокую светостойкость окрашенной поверхности с сохранением блеска исходной поверхности. Наибольшая цветовая гамма и насыщение тона могут быть получены на сплавах титана ВТ-20 (псевдо-α-сплав) и ВТ-6 (α+βсплав). На α+β-сплавах, содержащих молибден и хром, качество анодных пленок более низкое. На технически чистом титане цветовая гамма ограниченна. Сплавы титана, содержащие марганец (ОТ4, ОТ4-1) не рекомендуются для декоративного анодирования.
4.3 Анодирование в электролите комбинированного состава (импульсное).
Состав электролита:
Серная кислота (плотность 1,84) — 205 мл/л
Ортофосфорная кислота (плотность 1,7) — 15 мл/л,
Температура электролита 5 °С.
Длительность импульса тока — 0,1-0,3 сек., частота импульсов — 60-120 имп/мин, плотность тока в импульсе — 5-10 А/дм2. При этом в зависимости от соотношения длительности импульса и паузы формируются пленки различной толщины и качества. При плотности тока 1-2 А/дм2 толщина покрытия составляет 2-3 мкм, при наличии мощного источника питания можно получить толщину покрытия до 20 мкм. (при плотности тока до 50 А/дм2).
4.4 Анодирование титана в щавелевой кислоте.
Состав электролита:
Кислота щавелевая 50-60 г/л
Температура электролита 15-20 °С.
Плотность тока1-3 А/дм2.
Напряжение 110 В.
Время 30-60 мин.
5. Микродуговое оксидирование титана
МДО титана выполняется в электролите содержащим соли магния, кальция, алюминия.
Сущность процесса МДО на титане заключается в следующем. При наложении положительного потенциала на деталь, на поверхности образуется пленка диоксида титана TiO2. Когда подаваемое напряжение возрастает до некоторого критического значения, возникает пробой диэлектрического слоя TiO2 и образуется микродуга. Микродуговые разряды приводят к сильному разогреву электролита в каналах пор. Электролит разлагается и образуется атомарный кислород, который диффундирует в поверхность металла, вызывая ее окисление и обеспечивая рост пленки, которая на титане может достигать 50 мкм. Напряжение на ванне может доходить до 200 В. Полученное покрытие оказывается пористо. МДО титана, таким образом, происходит последовательным ростом диэлектрической пленки и ее пробоем, новым ростом, пробоем и т.д. На качество покрытия (твердость, пористость, пробивное напряжение) влияет жесткость разряда: время чисто электрохимического и время микродугового воздействия, а также величина тока, влияющая на температуру в разряде.
6. Механизм образования анодноокисного покрытия на титане.
Механизм образования и роста оксидных покрытий определяется химическим составом и кристаллическим строением исходного металла, видом применяемого электролита и технологическим режимом обработки. Важным фактором также является шероховатость исходной поверхности. На шероховатой поверхности можно получать прочные покрытия повышенной толщины с высокими значениями открытой пористости и адгезии, тогда как на гладкой поверхности толстослойное покрытие легко разрушается и отслаивается от основного металла.
6.1 Упрощенный механизм анодирования титана.
Упрощенно при анодировании титана происходит два противоположных процесса:
• электрохимическое образование анодной плёнки:
Ti + O2 = TiO2
• химическое растворение её в электролите:
TiO2 + H2SO4 = TiSO4 + H2O
Толщина плёнки зависит от соотношения скоростей указанных процессов. Скорость образования плёнки при неизменном электрическом режиме остаётся практически постоянной, затем падает из-за увеличения доли тока, приходящейся на выделение кислорода из раствора. Скорость же растворения, наоборот, непрерывно возрастает вследствие постепенного разрыхления плёнки.
Необходимым условием является возникновение пор на наименее устойчивых её участках при совместном действии тока и электролита. Через электролит, находящийся в порах, проходит ток. Объём пор при сернокислом анодировании составляет до 30%
Следует отметить, что сразу после подачи напряжения происходит рост барьерного слоя, (граница металл / анодный слой) создающего значительное сопротивление, что приводит к падению плотности тока впервые секунды анодирования. С увеличением толщины барьерного слоя увеличивается температура электролита в приэлектродном слое, что способствует повышению растворимости анодной пленки. Это приводит к тому, что сформировавшийся барьерный слой начинает несколько растворяться, что сопровождается уменьшением сопротивления и некоторым увеличением плотности тока. Падение тока приводит к частичному растворению оксида с образованием пор, а последующие скачки тока - к увеличению их диаметра. Это может быть связано с интенсификацией процессов разрастания пор в анодном оксиде в условиях достаточно интенсивного локального разогрева. При увеличении температуры при подаче напряжения анодирования происходит электрохимическая деструкция анодной плёнки. Для предотвращения этого необходимо охлаждение ванны.
6.2 Точный механизм анодирования титана в сернокислом электролите.
Анодирование титановых пластинчатых образцов с шероховатой пескоструйно обработанной поверхностью в электролите 200 г/л H2SO4 при сравнительно небольших значениях анодной плотности тока i=5 мА/см2 и продолжительности τ=2-5 мин приводит к тому, что по мере роста покрытия в толщину, при температуре электролитов 25-55°С, происходит сдвиг потенциала анодирования ∆Е в положительную область до величин 18-26 В (рисунок 13). При дальнейшем увеличении продолжительности обработки потенциалы анодирования стабилизируются при всех выбранных значениях температуры электролитов.
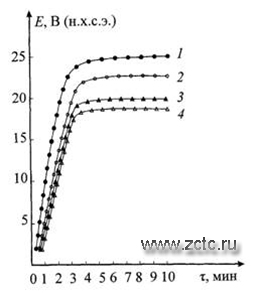
Рисунок 13 - Температурно-кинетические зависимости потенциалов анодирования титана: 1 - 25°С; 2 - 35 °С; 3 - 45 °С; 4 - 55 °С
В первом приближении установившиеся потенциалы анодирования Е∞ линейно уменьшаются при увеличении температуры электролитов с температурным коэффициентом ∂Е∞/∂Т = -0,27 В/К (рисунок 14). Время установления τ∞ этих стационарных потенциалов, напротив, увеличивается с повышением температуры электролитов и возрастает с температурным коэффициентом ∂τ∞/∂Т = 0,07 мин/К (рисунок 15).
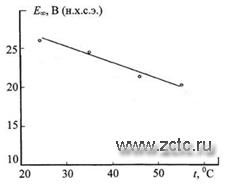
Рисунок 14 - Температурная зависимость установившегося потенциала анодирования титана (удалить 1 с графика).
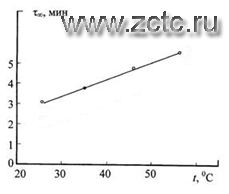
Рисунок 15 - Температурная зависимость времени установления стационарного потенциала анодирования(тоже удалить 1).
Отсюда следует, что анодирование пескоструйно обработанного титана в сернокислом электролите сопровождается существенным сдвигом значений потенциала анодирования ∆Е в положительную область.
Для расчета температурной зависимости скорости формирования j∞ оксидного покрытия в момент стабилизации потенциала анодирования Е∞ можно применить закон Фарадея в виде (перепечатать все формулы):
j∞=3MTiO2i ⁄ 4CTiO2F
Где:
η - выход по току,
MTiO2 и CTiO2- молекулярная масса и плотность диоксида TiO2,
F = 96500 Кл/моль.
Коэффициент z = 4 в знаменателе отвечает реакции анодного окисления титана:
Ti + 2H2O ⇔ TiO2 + 4H++ 4ē
с равновесным потенциалом E0p= -1,16 В по н.х.с.э., намного более отрицательным, чем установившиеся потенциалы анодирования Е∞ = 17-26 В по н.х.с.э., что указывает на высокую вероятность протекания реакции образования диоксида TiО2.
При значениях выхода по току η=1, молекулярной массе диоксида MTiO2 = 80 г/моль и его плотности CTiO2= 4,1 г/см2 расчет дает результаты, из которых следует, что переходные скорости формирования покрытия не зависят от температуры электролита и составляют j∞ = 2,5 нм/с (рисунок 16, кривая 1).
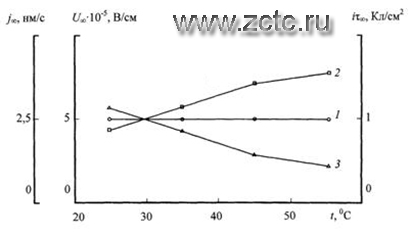
Рисунок 16 - Температурные зависимости переходной скорости роста j∞ покрытия (1), переходного количества электричества iτ∞ (2) и переходной напряженности электрического поля U∞ (3), полученные анодированием титана.
Полученный результат объясняется температурной компенсацией переходного количества электричества iτ∞ (рисунок 16, кривая 2) и падением напряженности поля U∞ в оксидном покрытии (рисунок 16, кривая 3).
Представленные данные позволяют определить окончание продолжительности анодирования титана, необходимой для получения оксидного покрытия с заданной толщиной, например, hTiO2 = 10-15 мкм. Расчеты показывают, что эта продолжительность составляет порядка hTiO2 / j∞= 67-70 мин при i = 5 мА/см2, η = 1 и практически не зависит от температуры электролита. Но учитывая, что в реальных условиях электролиза имеет место анодное растворение титана, протекающее при равновесном потенциале, равном E0p = - 1,14 В (н.х.с.э) по реакции:
Ti ⇔ Ti 4+ + 4ē
то часть количества электричества, пропускаемого через анод, расходуется на его растворение и значение выхода по току η при этом заметно уменьшается, за счет чего существенно возрастает продолжительность анодирования. Таким образом, основное влияние на рост толщины покрытия оказывает величина анодной плотности тока.
Для определения времени окончания анодирования можно использовать профилометрические данные по относительной шероховатости пескоструйно обработанных и анодированных поверхностей титана Өпо и Өа. Учитывая, что конкуренция между реакциями анодного оксидирования и растворения приводит к известному из практики анодной электрополировки титана эффекту сглаживания микронеровностей поверхности, то выход по току η можно оценить по соотношению:
η = Өа / Өпо
где относительная шероховатость поверхности Ө рассчитывается по формуле:
Ө = (2ξRa + (1-ξ)Rmax)/Sm
где:
ξ - – статистическая доля частиц абразива меньшего радиуса (при пескоструйной обработке) и Sm – средний шаг местных выступов профиля, мкм.
Соответствующее определение значений относительной шероховатости Ө и выхода по току η показало, что реакция анодного растворения титана действительно конкурирует с реакцией анодного оксидирования и потребляет примерно половину количества электричества, пропущенного через анод при среднем значении выхода по току, равном η = 0,47:
| Вид обработки поверхности | Пескоструйная | Анодирование в электролите №1 | Анодирование в электролите №1 |
| Ө | 0,47 | 0,23 | 0,21 |
| η | - | 0,49 | 0,45 |
При небольших значениях анодной плотности тока это приводит к более чем двукратному возрастанию времени окончания электролиза до величины порядка 2 ч.
Действительно, оптико-микроскопическое измерение толщины покрытий на поперечных микрошлифах анодированных образцов, показало достижение ее значений до существенных величин, составляющих 20-30 мкм за продолжительность обработки τ = 4-6 ч при плотности тока 5-10 мА/см2. С возрастанием плотности тока до 50 мА/см2 толщина покрытий достигала 10 мкм при анодировании титана за продолжительность обработки 0,3 ч.
Для дальнейшего исследования механизма и кинетики сернокислотного анодирования титана следует рассмотреть вольтамперные характеристики (ВАХ) его анодного поведения при продолжительности обработки τ = 5 мин, гарантирующей стационарность потенциалов анодирования Е∞ (рисунок 17).
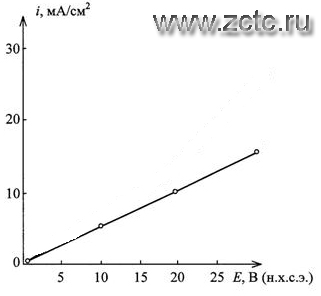
Рисунок 17 - Вольтамперные характеристики анодного поведения пескоструйно обработанного титана при t=55 °С
Полученные данные согласуются с моделью омического контроля анодных реакций и твердофазной миграцией катионов Ti4+ через оксидный слой в условиях относительно малой напряженности электрического поля в нем, составляющей U∞ = (2,3-8)·105 В/см (рисунок16, кривая 3).
Совокупность полученных экспериментальных результатов интерпретируется с помощью изложенных ниже представлений о механизме и кинетике анодного оксидирования титана.
Известно, что переходные многовалентные металлы, в частности титан, при анодном растворении не отдают все свои валентные электроны в одном элементарном акте. Поэтому, для титана можно предложить следующую четырехстадийную схему анодного растворения:
Ti ⇔ Ti + + ē , (1)
Ti+ ⇔ Ti 2+ + ē , (2)
Ti2+ ⇔ Ti 3+ + ē , (3)
Ti3+ ⇔ Ti 4+ + ē . (4)
Такая схема реакций характеризуется отрицательными (по н.в.э) значениями равновесных электродных потенциалов, равными E0p= -1,75 В – для реакции (2), E0p = -0,37 В – для реакции (3) и E0p= -0,04 В – для реакции (4). Реакции анодного растворения титана (1)-(4) вероятнее всего протекают с участием компонентов электролита анодирования. Для сернокислых растворов такими электроактивными компонентами являются анионы HSO-4 , катионы Н+ (Н3О+) и молекулы воды. В связи с этим схема реакций растворения титана (1)-(4) может быть модифицирована с учетом участия в них компонентов сернокислого электролита анодирования следующим образом:
Ti + H2O⇔ TiOH + H++ ē, (5)
TiOH + HSO4-⇔ TiSO4 + H2O + ē, (6)
TiSO4 + H2O⇔ TiOHSO4 + H++ ē, (7)
TiOHSO4 + 2H+⇔ Ti 4+ HSO4- +H2O + ē . (8)
Анализ электрохимических реакций (5)-(8) показывает, что компоненты сернокислого электролита выступают в качестве катализаторов реакций (1)-(4) и ускоряют их, не сдвигая электродные равновесия в системе. Поэтому, на основании приведенных выше значений стандартных электродных потенциалов можно заключить, что наиболее быстрой реакцией будет являться реакция образования TiОН (5). Поскольку сернокислые электролиты анодирования имеют большую концентрацию катионов водорода Н+, то на границе титана с электролитом наиболее высока активность адсорбированных катионов одновалентного титана Ti+, образующихся по химической реакции:
TiOH + H+⇔ Ti+ + H2O,
В параллельном анодном процессе протекает реакция окисления OH- до пероксидного аниона:
3OH-⇔ HO2- + H2O + 2ē,
характеризуемая стандартным равновесным электродным потенциалом, равным E0p = 0,88 В по н.в.э. Далее образуется анион кислорода O2- по реакции:
HO2- + OH-⇔ O2-+ H2O + ē,
Основная реакция анодного оксидирования титана реализуется в виде химического окисления одновалентного катиона титана Ti+ анионом кислорода O2-:
Ti+ + O2-⇔ TiO2, (9)
По мере роста титанооксидного покрытия в толщину описанные выше процессы анодного растворения и оксидирования переходят с поверхности титана в объем покрытия и начинают контролироваться твердофазной ионной миграцией катионов титана и анионов кислорода, для выражения которой можно записать соответствующие уравнения Нернста-Планка:
 (10)
(10)
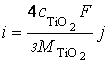 (11)
(11)
Где:
х – нормальная координата, отсчитываемая от поверхности оксидного покрытия,
Y+ и Y–, σ+ и σ–, μ+ и μ– – потоки катионов титана и анионов кислорода, катионные и анионные удельные электропроводности оксидного покрытия, химические потенциалы катионов титана и анионов кислорода в соединении TiO2, соответственно,
φ – потенциал внутрипленочного электрического поля
F = 96487 Кл/моль – постоянная Фарадея.
С учетом условия электронейтральности оксидного покрытия в виде равенства:
Y+ - Y–=0 (12)
из формул (10), (11) можно исключить градиент внутрипленочного электрического потенциала φ:

получив в результате уравнение для потока миграции анионов кислорода O2-:
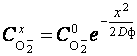
Если принять, что удельная электропроводность катионов титана в оксидном покрытии намного больше удельной электропроводности анионов кислорода σ+>>σ–, то предыдущее выражение легко упрощается:
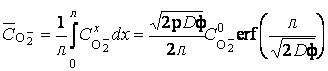 (13)
(13)
Интегрируя уравнение (13) по х, получаем:
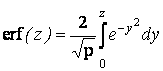 (14)
(14)
где M-0– химический потенциал анионов O2-на поверхности оксидного покрытия и M-x– химический потенциал анионов O2-на глубине покрытия х.
При небольшой концентрации анионов O2- удельная электропроводность покрытия σ– связана с коэффициентом его твердофазной диффузии D и описывается законом Нернста-Эйнштейна:
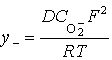
где CO-2 - концентрация анионов O2-, R = 8,314 Дж/(моль·К) и Т – абсолютная температура анодирования.
Поэтому уравнение (14) можно выразить в виде:
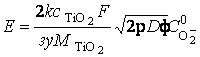 (15)
(15)
С другой стороны поток миграции анионов кислорода можно определить и через скорость движения фронта миграции анионов O2-:
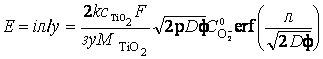 (16)
(16)
где τ – продолжительность анодирования.
Примем параболический закон движения фронта миграции анионов O2- в виде:
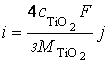 (17)
(17)
где k– константа скорости роста толщины покрытия.
Тогда, после приравнивания уравнений (15) и (16) с учетом (17), получаем выражение для константы скорости роста покрытия:

При небольшой концентрации анионов кислорода CO-2 величина коэффициента твердофазной диффузии D покрытия не зависит от его концентрации и химического потенциала. Поэтому, с учетом того, что активность анионов O2- в титанооксидном слое совпадает с их малой концентрацией CO-2 из предыдущего уравнения можно записать:
 (18)
(18)
где: C0O-2 и CxO-2 – твердофазные концентрации анионов O2- на поверхности оксидного покрытия и в его глубине х.
Поскольку на основании выражения (17) константа скорости роста покрытия прямопропорциональна квадрату его глубины и обратнопропорциональна продолжительности анодирования k = x2/2τ, то после потенциирования уравнения (18) получаем формулу для определения твердофазной концентрации анионов O2- на глубине покрытия х:
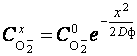
Таким образом, концентрация анионов кислорода уменьшается с квадратом глубины их проникновения х2 и увеличивается с повышением продолжительности анодирования τ по экспоненциальному закону. Кроме этого, она сильно возрастает с увеличением температуры анодирования t и коэффициента твердофазной диффузии D, нарастающим со степенью структурной дефектности формирующегося оксидного покрытия.
Для дальнейшего исследования кинетики анодирования титана целесообразно задаться некоторой эффективной глубиной λ миграции анионов O2- и определить их среднюю концентрацию CO-2 по этой глубине:
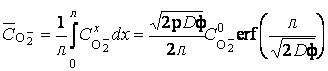 , где
, где
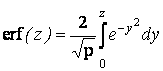 - функция ошибок.
- функция ошибок.
Можно принять, что в пределах 0 ≤ х ≤ λ скорость линейного роста оксидного покрытия в толщину j пропорциональна средней концентрации анионов кислорода CO-2
j=kCO2
что соответствует протеканию реакции (14) по закономерностям кинетики реакций первого порядка при избытке твердофазной концентрации катионов титана.
Тогда на основании линейности вольтамперной характеристики сернокислотного анодирования титана, обусловленной омическим контролем, можно записать выражение для потенциала анодирования Е:
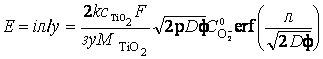 , (19)
, (19)
где:
i – анодная плотность тока, σ – суммарная ионная и электронная проводимость покрытия из диоксида TiO2,
CTiO2 и MTiO2 – плотность и молекулярная масса покрытия, η ≤ 1 – выход по току.
Принято, что основное падение величины потенциала происходит в пределах эффективной глубины проникновения λ анионов кислорода.
Величина анодной плотности тока i рассчитывается по закону Фарадея:
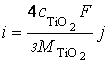 . (20)
. (20)
Анализ полученного кинетического уравнения представляет интерес для анодирования титана при малых и больших значениях продолжительности, поскольку функция ошибок

при z→0 и erf (z) = 1 при z ≥2
При небольшой продолжительности анодирования τ = τ0 ≤ λ2/8D из выражения (19) получается параболический закон роста потенциала Ес√Φ :
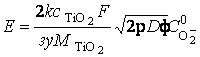 , (21)
, (21)
соответствующий нарастающим участкам экспериментальных кривых Е – τ (рисунок 13) и эффективной глубине проникновения λ анионов кислорода по всей малой толщине оксидного покрытия.
При больших значениях продолжительности электролиза τ = τ∞>>λ2/2D и повышенной толщине покрытия происходит установление потенциала анодирования Е∞ до стационарных величин и он перестает зависеть от τ ≥ τ∞. Поэтому из уравнения (19) выражаем стационарный потенциал Е∞, который также соответствует экспериментальным данным и эффективной глубине проникновения λ анионов кислорода лишь в небольшую приповерхностную область растущего анодно-оксидного покрытия (рисунок 13).
Линейное уменьшение стационарного потенциала Е∞ с температурой анодирования титана объясняется ростом ионной компоненты удельной электропроводности оксидного покрытия σ, входящей в знаменатель уравнения (22) (рисунок 14). Увеличение продолжительности обработки и температуры электролита отвечает снижению потенциала анодирования Е на начальных стадиях процесса (рисунок 13) и повышению времени его установления τ∞ до стационарных значений (рисунок 15), что также связано с температурным увеличением электропроводности покрытия σ по соотношению (21).
Температурная независимость линейной скорости роста j титанооксидного покрытия в толщину определяется постоянством значения выхода по току η согласно закону Фарадея (20) (рисунок 16).
Читайте также статьи
Механизм анодирования алюминия
Анодное оксидирование алюминия.Механизмы процесса.
Механизм цинкования
Описание процесса гальванического цинкования. Электролиты.
Перечень видов анодировки
Ассортимент оксидных покрытий в различные цвета

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



