
Механизм и технология гальванического золочения. Структура и свойства золотых покрытий.
Содержание:
1. Что такое золото? Свойства золота.
2. Электролиты золочения поверхности металлов.
3. Нецианистые электролиты золочения.
1. Что такое золото? Свойства золота.
Золото (Au от латинского Aurum) принадлежит к 11 группе периодической системы Д.И.Менделеева. Оно относится к типичным благородным металлам и имеет нехарактерный для них желтый цвет. Атомная масса и плотность золота велики: 196,97 г/моль и 19,32 г/см³ соответственно, стандартные электродные потенциалы очень положительные: Au+ = +1,83 В, Au3+ = +1,52 В.
Золото отличается высокой температурой плавления 1064,18° С, выраженной пластичностью и отличной тепло- и электропроводностью. Его удельное электрическое сопротивление в чистом виде составляет 0,024 Ом*мм.
С точки зрения химических свойств при нормальных условиях золото инертно к большинству кислот и не образует оксидов.
Золото растворяется только в царской водке, ртути, щелочных цианистых растворах, концентрированной селеновой кислоте при 200° C, хлорной и бромной воде, хлорной кислоте.
Покрытия золотом и его сплавами нашли широкое применение в электронике и художественной обработке изделий. Как антикоррозионное покрытие золото можно применять только при условии его беспористости. Его электродный потенциал столь положителен, что в паре с электроотрицательными металлами типа железа в порах покрытия будет образовываться очень жесткая коррозионная гальванопара.
Обозначение гальванического золочения - Зл.
Толщина наносимого покрытия может варьироваться от 0,025 мкм до 20 мкм в зависимости от назначения.
По своим физико-химическим свойствам гальваническое золото может отличаться от металлургического. Так, в процессе электролиза в золото могут включаться примеси. Это вызовет как изменения в части электропроводности, так и в части пластичности. Так, напряжения в покрытии могут иметь как положительный, так и отрицательный характер. Электропроводность же всегда будет снижаться.
Легирование золотых покрытий никелем, кобальтом, серебром и сурьмой повышает их микротвердость, износостойкость, коррозионную стойкость и мелкокристалличность.
Чистое золотое покрытие имеет:
- микротвердость: 1046 МПа;
- износостойкость: 1 (условно);
- удельное электросопротивление, по разным источникам: 0,030-0,050 Ом*м;
- переходное электросопротивление при Р = 0,2Н и силе тока 50А: 0,0031-0,0041.
При легировании никелем можно получить: - микротвердость до 2500 МПа;
- износостойкость 10 (относительно чистого золота);
- переходное электросопротивление при Р = 0,2Н и силе тока 50А: 0,0031-0,0041;
- удельное и переходное электросопротивление:
|
Массовая доля никеля в сплаве с золотом |
Удельное электрическое сопротивление |
Переходное электрическое сопротивление при Р=0,2 и силе тока 50А |
|
5 |
0,150 |
0,0041 |
|
10 |
0,220 |
0,0017 |
|
15 |
0,400 |
0,0100 |
При введении кобальта:
- микротвердость: до 2990 МПа;
- износостойкость: до 15 (относительно чистого золота);
- удельное и переходное электросопротивление:
|
Массовая доля кобальта в сплаве с золотом |
Удельное электрическое сопротивление, Ом*м |
Переходное электрическое сопротивление при Р=0,2 и силе тока 50 мА |
Переходное электрическое сопротивление при Р=0,2 и силе тока 50А |
|
1 |
0,040 |
- |
- |
|
5 |
0,140 |
0,0062 |
0,0042 |
|
10,1 |
1,150 |
0,0130 |
0,0070 |
|
17,) |
1,150 |
0,0130 |
0,0076 |
При введении серебра:
• микротвердость и износостойкость:
|
Массовая доля серебра в сплаве с золотом |
Микротвердость, МПа |
Износостойкость (относительно чистого золота) |
|
4,8 |
1400 |
4 |
|
10 |
1650 |
- |
|
16 |
1840 |
- |
|
31 |
1850 |
9 |
• удельное и переходное электросопротивление:
|
Массовая доля серебра в сплаве с золотом |
Удельное электрическое сопротивление, Ом*м |
Переходное электрическое сопротивление при Р=0,2 и силе тока 50А |
Переходное электрическое сопротивление при Р=0,5 и силе тока 50А |
|
4,8 |
0,09 |
0,0039 |
0,0022 |
|
10 |
0,08 |
0,0033 |
0,0022 |
|
16 |
0,12 |
0,0033 |
- |
|
31 |
0,125 |
0,0040 |
0,0028 |
При введении сурьмы:
• микротвердость:
|
Массовая доля сурьмы в сплаве с золотом |
Микротвердость, МПа |
|
2 |
2030 |
|
5 |
2100 |
|
10 |
2350 |
|
15 |
2600 |
• износостойксть 15 (относительно чистого золота).
• удельное и переходное электросопротивление:
|
Массовая доля сурьмы в сплаве с золотом |
Удельное электрическое сопротивление, Ом*м |
|
2 |
0,088 |
|
5 |
- |
|
10 |
0,380 |
|
15 |
0,520 |
• переходное электросопротивление при Р = 0,5Н и силе тока 50А: 0,0050.
Легированные сплавы золота имеют характерные цвета, которые часто применяют в художественной отделке. Например, самые популярные: зеленое золото - сплав с серебром, розовое золото - сплав с медью.
2. Электролиты золочения поверхности металлов.
2.1 Цианистые электролиты.
При золочении используют цианистые и нецианистые электролиты. Цианистые в свою очередь делятся на кислые, щелочные и нейтральные.
Все цианистые электролиты содержат то или иное количество свободного цианида калия.
В щелочных и нейтральных растворах золото находится в основном в виде комплекса K[Au(CN)2]. Присутствие трехвалентного комплекса K[Au(CN)4] возможно в незначительных количествах.
2.1.1 Катодный процесс в цианистых электролитах золочения.
Реакция, определяющая потенциал электрода:
[Au(CN)2]- = AuCN + (CN)-
AuCN = Au+ + (CN)-
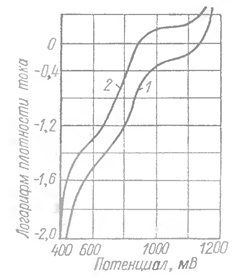
Катодные поляризационные кривые для щелочного электролита приведены на рисунке 1, поляризация электроосаждения золота из кислых и нейтральных растворов находится в области более положительных значений.

Рисунок 1 - Поляризационные кривые золота в щелочном цианистом электролите (г/л Ag в пересчете на металл): 1 - 17, 2 - 30.
Рассмотрим поляризационные кривые на рисунке 1 более подробно:
• На 1 и 2 участках кривых при потенциале от -0,4 до -0,6 В в элементарной реакции участвуют AuCN или Au2(CN)2.
• На 3 и 4 участке при потенциале от -0,7 до -0,9 В - [Au(CN)2]-.
• На 5 участке - [Au(CN)2]- и Н+. Под воздействием сильного электрического поля в ДЭС у катода происходит адсорбция аниона [Au(CN)2]- положительным концом к катоду, что облегчает процесс разряда:
[Au(CN)2]- + e = [Au(CN)2]2-
[Au(CN)2]2- = Au + 2(CN)-
Трехвалентный комплекс золота изучен очень мало. Одним из исследователей был А.Кнодлер. Известно, что нагрев щелочного электролита и повышение рН способствует образованию одновалентного золота. Если рассмотреть реакции:
[Au(CN)4]- = [Au(CN)2]- + (CN)2
(CN)2 + 2(OH)- = (CN)- + (CNO)- + H2O
[Au(CN)4]- + 2(OH)- = [Au(CN)2]- + (CN)- + (CNO)- + H2O
то становится очевидным, что разложение трехвалентного комплекса золота действительно должно ускоряться с ростом рН (увеличением концентрации OH-).
В нейтральных и кислых растворах трехвалентный комплекс устойчив даже при нагреве.Если в растворе присутствует трехвалентный комплекс золота, то его разложению способствует металлическое золото и свободный цианид:
[Au(CN)4]- + 2Au + 2(CN)- = 3 [Au(CN)2]-
В качестве металлического золота могут выступать аноды, позолоченные детали, оставленные без тока, частички золотого шлама и остатков покрытия, упавших в ванну.
Катодный выход по току в щелочных растворах может достигать - 70-80%, нейтральных - почти 100%, кислых - 30-40%. Работа на низких плотностях тока сопровождается снижением ВТ. Уже осажденное золотое покрытие при этом растворяется по реакциям:
2Au + 4KCN + O2 + 2H2O = 2K[Au(CN)2] + H2O2 + 2KOH
2Au + 4KCN + H2O2 = 2K[Au(CN)2] + 2KOH
2.1.2 Анодный процесс в цианистых электролитах золочения.
Анодный процесс при золочении имеет некоторые аномалии - как в механизме, так и в выходе по току. Аномалии в основном связаны с возможностью образования комплексов трехвалентного золота.
Возможно использование растворимых и нерастворимых анодов:
- Растворимые аноды при золочении можно применять только в щелочных цианистых растворах. Они могут растворяться химически в цианидах, что повышает анодный выход по току. Со временем трехвалентный комплекс восстанавливается и анодный процесс стабилизируется.
- В качестве нерастворимых анодов используются платинированные / ирридированные титановые пластины или сетки.
3. Нецианистые электролиты золочения.
Нецианистые электролиты названы так условно. В них нет свободных цианидов, однако разряжающийся комплекс золота все-таки содержит ионы циана.
Основное применение нашел железистосинеродистый электролит. Готовят его кипячением хлорного золота с содой и K4Fe(CN)6:
12(AuCl4)- + 3[Fe(CN)6]4- = Au4[Fe(CN)6]3 + 8(AuCl4)- + 16Cl
По мнению некоторых авторов золото в нем содержится в трехвалентной форме, по мнению других валентность золота не определена точно.
Данный электролит является относительно неядовитым, покрытия имеют хорошее качество.
Читайте также статьи
Механизм серебрения
Что такое серебро? Механизм серебрения из цианистого электролита. Виды электролитов.
Механизм оловянирования (лужения)
Что такое олово и висмут? Механизм оловянирования и структура покрытия
Токопроводящие кристаллы (усы) на оловянном покрытии
Природа оловянных усов и механизм их образования

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



