

Вода | Строение молекулы и структура воды в жидком, твердом и газообразном виде.
Содержание:
2. Структура воды. Водородные связи.
3. Структура воды в жидком виде.
4. Особенности строения воды в твердом виде. Лед.
5. Особенности строения воды в газообразном виде. Пар.
1. Современные представления о составе и структуре воды. Строение молекулы воды. Легкая и тяжелая вода.
• Опорные даты начала исследования воды:
1781 г. - Вода впервые была синтезирована Г.Кавендишем при сгорании водорода;
1783 г. - Лавуазье предложил истинный состав воды как сложного соединения кислорода и водорода;
1800 г. - А.Карлейль и У.Никольсон с помощью тока, полученного в вольтовом столбе, разложили воду на кислород и водород;
1805 г. - Жозеф Луи Гей-Люссак и А.Гумбольдт, проведя совместные опыты, установили, что для образования воды необходимы 2 объема водорода и 1 объем кислорода;
1842 г. - Жан Батист Дюма установил весовое соотношение водорода и кислорода в воде как 2:16;
1860 г. - С.Канницаро предложил точную химическую формулу воды как H2O.
• К настоящему времени предложено более 100 моделей структуры воды, начиная с работ Дж. Бернала и Р. Фаулера.
Мы знаем, что вода существует в жидком, газообразном и твердом виде. Но возможны и субструктуры, отличающиеся по свойствам в рамках одного и того же агрегатного состояния. Посмотрите на общую фазовую диаграмму воды: римскими цифрами показаны различные структурные модификации льда.

Рисунок 1 - Фазовая диаграмма воды.
В "тройной" точке на диаграмме может одновременно существовать вода во всех трех агрегатных состояниях.
В "критической" точке все свойства жидкости и пара (энергия, плотность, структура, характер движения частиц и т.п.) становятся равны. При более высоком давлении и/или температуре агрегатное состояние воды называют "сверхкритическим".
В молекуле воды три атома: два водорода и один кислород. Между собой они соединены ковалентной связью. Молекула является двойным симметричным донором и акцептором протонов. Атом кислорода имеет две неподеленные пары электронов. Это определяет структуру воды и ее строение в виде равнобедренного треугольника, в вершине которого расположен атом кислорода, а в основании - два водорода (рисунок 2).
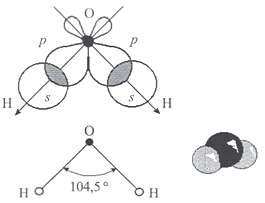
Рисунок 2 - Электронная и геометрическая модель структуры молекулы воды.
В стабильном энергетическом состоянии молекула воды имеет тетраэдрическую пространственную структуру. При изменении агрегатного состояния воды длина сторон и угол между ними меняются. Если бы мы увидели молекулу воды, то обнаружили, что она имеет сфероидальную форму с двумя выпуклостями (рисунок 3).
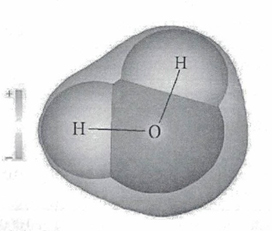
Рисунок 3 - Локальное распределение некомпенсированных зарядов в молекуле воды.
Молекула воды полярна, т.е. один ее конец имеет частичный положительный заряд, а другой - отрицательный. Это объясняется тем, что две пары электронов в ней - общие у двух атомов водорода и атома кислорода, а две другие пары неподеленных электронов собраны с противоположной стороны кислорода. Поэтому на атомах водорода проявляются частично нескомпенсированные положительные заряды, а на кислороде - отрицательные.
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар обуславливает возникновение водородных связей, что способствует ассоциации молекул воды в группы.
Обладая значительным дипольным моментом, молекулы воды также сильно взаимодействуют с полярными молекулами других веществ.
Идеально чистую воду практически невозможно получить. По факту, мы всегда будем иметь дело хоть и с очень разбавленными, но растворами.
Кроме известной нам "легкой" воды 1H216O (где надстрочный индекс - атомная масса элемента), существует еще 8 изотопологов, в которых вместо обычного водорода и кислорода содержатся их изотопы: 1HD16O (D-дейтерий или 2H), D216O, 1H217O, 1HD17O, D217O, 1H218O, 1HD18O, D218O (самая "тяжелая" вода).
В природе на 1 000 000 молекул воды в среднем приходится:
- 997 284 молекул легкой воды 1H216O;
- 311 молекул 1HD16O;
- 390 молекул 1H217O;
- 2005 молекул 1H218O.
Если из глубинной океанической воды, отвечающей стандарту SMOW (Standard Mean Ocean Water) удалить все тяжелые изотопы и заменить их на 1H216O, то масса 1 л такой воды станет меньше на 250 мг, т.е. на четверть.
2. Структура воды. Водородные связи.
Структура - есть конкретное пространственное расположение атомов, ионов или молекул в соответствии с особенностями их взаимодействия между собой.
Существует несколько базовых гипотез строения воды. Две основных:
• Гипотеза Уайтинга (1883). Вода в жидком виде состоит из гидролей, а точнее из смеси моногидроля H2O, дигидроля (H2O)2, и тригидроля (H2O)3. Основной строительной единицей здесь является дигидроль. Отметим, что по этой гипотезе пар состоит преимущественно из моногидроля, а лед - из тригидроля.
• Гипотеза О.Я. Самойлова, Дж. Попла, Г.Н. Зацепиной (XX век). Вода, пар или лед состоят из простых молекул H2O, объединенных в группы или агрегаты с помощью водородных связей (Дж. Бернал, Р. Фаулер 1933).
Последователей второй гипотезы значительно больше, поэтому остановимся на ней подробнее.
Электронная конфигурация молекулы H2O позволяет ей быть одновременно и донором и акцептором электронов. Этот факт является важной предпосылкой к образованию разветвленной сети водородных связей (рисунок 4), как уже было упомянуто ранее. Лед в этом отношении совершенен.
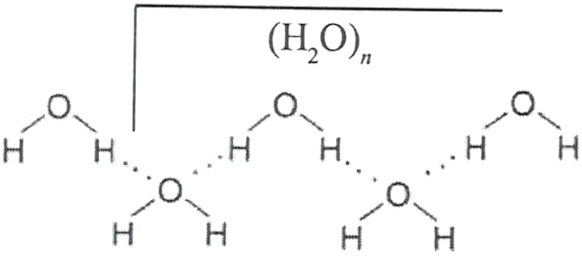
Рисунок 4 - Образование водородных связей между молекулами воды. Сплошные линии - ковалентные связи, точечные - направленные водородные связи.
Расчетами установлено, что в любом объеме воды всегда найдется, по крайней мере, одна сплошная цепочка из водородных связей, пронизывающая весь объем. Если представить в виде этого объема мировой океан, то, согласно этого постулата, в нем точно найдется одна гигантская ассоциация молекул воды, опоясывающая земной шар. Известен афоризм И. Ленгмюра: "Океан - одна большая молекула". Сегодня достоверно установлено, что из каждых 10 молекул воды 8 по прежнему окружены соседями.
В ходе современных физико-химических исследований были выявлены характерные структурные агрегаты воды, формирующиеся с помощью водородных связей.
Для формирования трехмерных структур необходимо, кроме способности молекул создавать водородные связи, выполнение еще двух условий. Этих связей должно быть не менее четырех на одну молекулу и геометрические размеры молекулы не должны противоречить оптимальным направлениям водородных связей. Вода удовлетворяет этим требованиям. Так, нагревая лед мы получаем смесь жидкой воды и кристаллов льда, температура которой останется неизменной до тех пор, пока все кристаллики не расплавятся. Это говорит о том, что подводимое нами тепло будет расходоваться в первую очередь на разрушение водородных связей льда.
3. Структура воды в жидком виде.

Жидкость, как известно, отличается от других агрегатных состояний вещества своей текучестью, т.е. способностью неограниченно менять форму под действием касательных механических напряжений, сохраняя при этом объем. Жидкость способна течь даже под свей неподвижной поверхностью. Молекулы жидкости не имеют своего строго определенного места, но, все же, им недоступна полная свобода перемещения, как в паре.
Структура жидкости есть статистическая закономерность межмолекулярных расстояний и ориентаций, характерных для плотно упакованных систем.
Согласно одной из первых моделей воды Бернала и Фаулера, основанной на рентгеноструктурном анализе, существует три формы расположения молекул в жидкой воде:
- При температуре ниже 4° С - льдоподобная структура тридимита;
- При обыкновенной температуре - кварцеподобная структура;
- При высоких температурах - плотнейшая структура.
Эта теория оказалась верной лишь методологически, многие ее детали на практике не подтвердились. Однако, главное ее достижение - идея о наличии тетраэдрической сетки.
В 1951 г. Дж. Попл предложил модель воды в виде непрерывной сетки (рисунок 5), отличной от модели Бернала и Фаулера. Отличия заключались в том, что сетка была случайной, связи в ней искривлены и имеют различную длину.

Рисунок 5 - Модель жидкой воды Дж.Попла.
Попл объяснял уплотнение воды при плавлении искривлением связей. Однако, данная модель не могла объяснить нелинейность зависимости свойств воды от температуры и давления.
Почти одновременно с идеей Попла возникли кластерные и клатратные модели, которые можно обозначить как "смешанные".
Кластерная модель представляла жидкую воду как кластеры из молекул, связанных водородными связями, плавающих в объеме свободных молекул. В группе кластерных моделей выделяется теория Г.Немети и Х.Шераги (рисунок 6). Отметим, что в данной модели разрушение одной водородной связи приводит к разрушению всего кластера. Разрушение и образование кластеров происходит постоянно.
Рисунок 6 - Кластерная модель Г.Немети и Х.Шераги.
Кластерная модель не говорит о расположении молекул в гроздьях, но авторы предполагают наличие отдельных "роев". При этом постулируется тот факт, что большинство молекул должно быть тетракоординировано. Состояние молекул будет определяться количеством водородных связей, которые она образует (0-5).
Удар по кластерной теории наносят исследования Г.Стэнли на основе теории перколяции (протекания). Г.Стэнли доказывает невозможность существования в воде изолированных кластеров.
Клатратная модель говорила о воде как о непрерывной сетке-каркасе связанных молекул, внутри которого содержались пустоты со свободными молекулами.
Первую модель клатратного типа предложил О.Я.Самойлов в 1946 году. В ее основе лежало представление о жидкой воде как о испорченной, размытой структуре льда Ih с частичным заполнением полостей мономерами. В процессе движения молекул решетка постоянно перестраивается. Настройкой свойств и концентраций микрофаз, а также параметрами пустот легко можно было объяснить все закономерности свойств воды.
Сегодня существует еще много вопросов о воде в метастабильных состояниях, в частности - аморфных. Дальнейшее исследование структуры воды продолжается на основе компьютерного моделирования и численных экспериментов. Сегодня на эту тему опубликовано несколько тысяч работ, среди которых оригинальными являются работы Г.Г. Маленкова. В работах по моделированию воды используется 2 критерия: геометрический и энергетический.
Пустоты в воде по результатам моделирования имеют тенденцию объединяться друг с другом, образуя еще более крупные пустоты, как показано на рисунке 7.
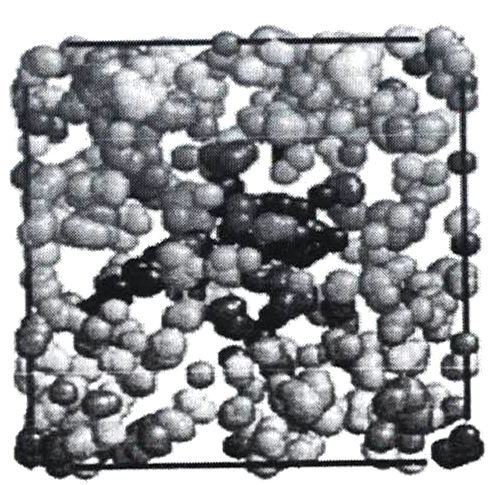
Рисунок 7 - Размещение пустот в пространстве (3456 молекул при температуре 300К).
По результатам компьютерного моделирования структуры воды можно сделать однозначные выводы, что в ней существует трехмерная сетка из молекул, соединенных водородными связями. Сетка структурно и динамически неоднородна, не похожа на структуру кристаллов. Время жизни водородной связи в сетке составляет несколько пикосекунд (10-12 с). На рисунке 8 представлена принципиальная схема эволюции кластера.
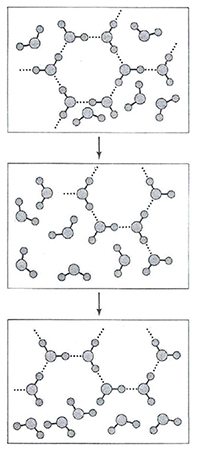
Рисунок 8 - Эволюция кластеров из молекул воды в рамках модели числового моделирования.
Рассмотрим кластерную и клатратную модели строения жидкой воды подробнее.
3.1 Кластерная модель строения жидкой воды.
Согласно квантово-химическим расчетам большей устойчивостью обладают линейного "открытого" димера воды, по сравнению с циклическими формами. В случае цикла выгодными являются трех-четырех- и пятичленные образования, в которых водородные связи имеют одинаковое направление. Для шестичленного цикла выгодным становится структура типа "кресло".
Одно из первых изображений формирования циклических кластеров воды приведено на рисунке 9.
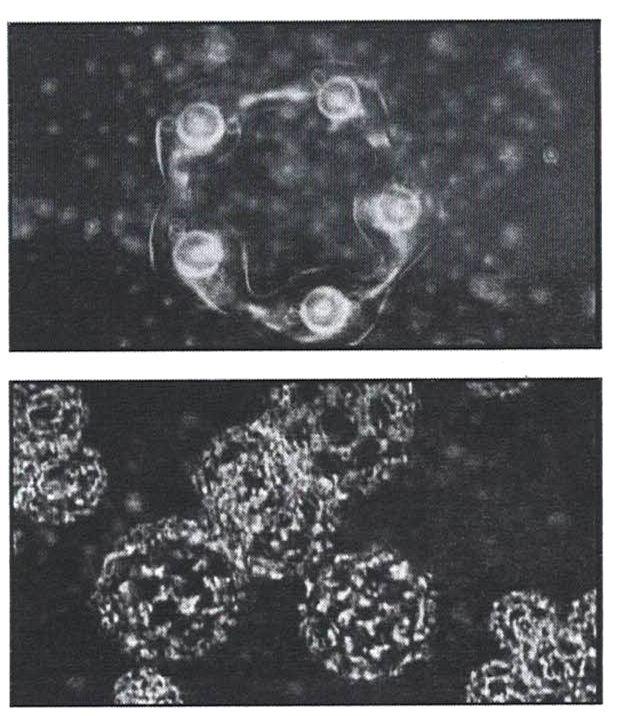
Рисунок 9 - Формирование циклического кластера воды.
Большой вклад в возможность формирования и устойчивость кластеров воды во времени внесли работы Г.А.Домрачева и Д.А. Селивановского. Они доказывали существование механохимических реакций радикальной диссоциации воды. Доказательство основывалось на том, что вода, по их мнению, представляет собой динамически нестабильную полимероподобную систему и по аналогии с механохимическими реакциями в полимерах при механическом воздействии на воду поглощенная водой энергия используется для разрыва химических связей H-OH. Реакция разрыва связи может выглядеть так:
(H2O)n(H2O...H-|-OH)(H2O)m + e(H2O)n+1(H) + (OH)(H2O)m
где: е - неспаренный электрон.
Рассчитав эффективность механодиссоциации воды, авторы пришли к выводу, что кислород на Земле появился при диссоциации воды.
Итак, вода, по мнению Г.А.Домрачева и Д.А. Селивановского - это громадный полимер из молекул воды, связанных водородными связями. Интересно, что в молекуле классического полимера атомы объединены ковалентными связями. При этом установлено, что водородная связь между молекулами воды во льду имеет на 10% ковалентный характер.
В 1993 г. К.Джордан предложил свои варианты устойчивых "ассоциатов воды", которые состоят из 6 молекул (рисунок 10).
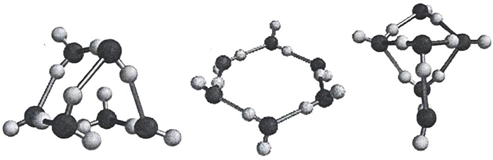
Рисунок 10 - Образование ассоциатов воды по К.Джордану.
По Джордану кластеры могут объединяться и друг с другом, и со свободными молекулами воды за счет водородных связей, формируя более крупные ассоциаты. Такие кластеры могут объединяться как друг с другом, так и со свободными молекулами воды.
Квантово-химические расчеты нанокластеров с общей формулой (H2O)n с n=6-20 показали, что самые устойчивые структуры образуются посредством взаимодействия тетрамерных и пентамерных кольцевых структур (рисунок 11). На рисунке ниже показаны возможные структуры конформации кластеров воды.
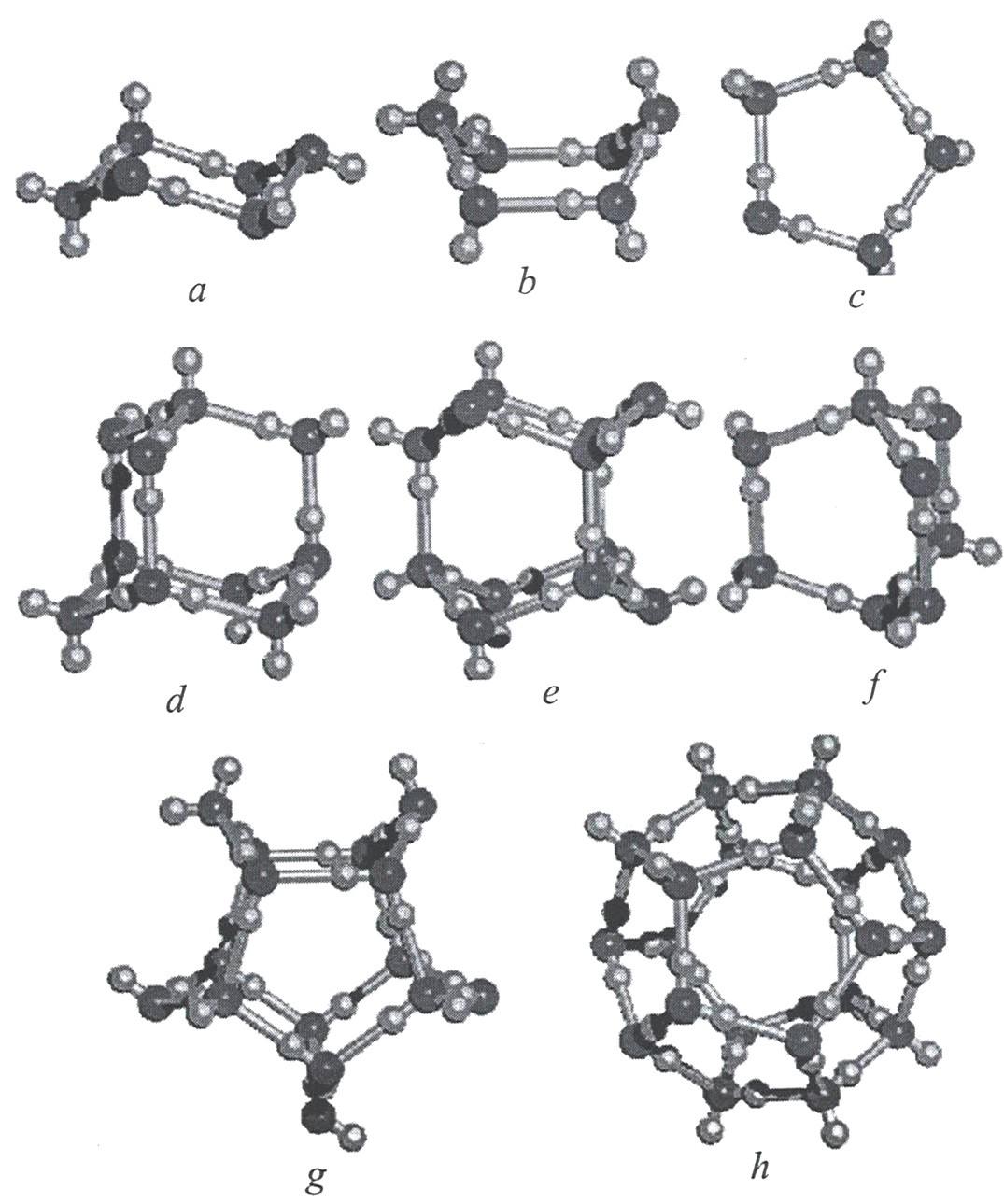
Рисунок 11 - Возможные структуры и конформации кластеров воды (a-h) состава (H2O)n, где n=5-20: a,b - 6, d - 10, e - 12, f - 8, g - 15, h - 20.
Считается, что тетрагональная структура льда разрушается при плавлении с образованием смеси, состоящей из три-, тетра-, пента-, гексамеров воды и свободных молекул.
В 1999 г. Р.Секайли удалось расшифровать строение тримера воды, а в 2001 г. - тетрамера, пентамера и гексамера, структуру клетки:
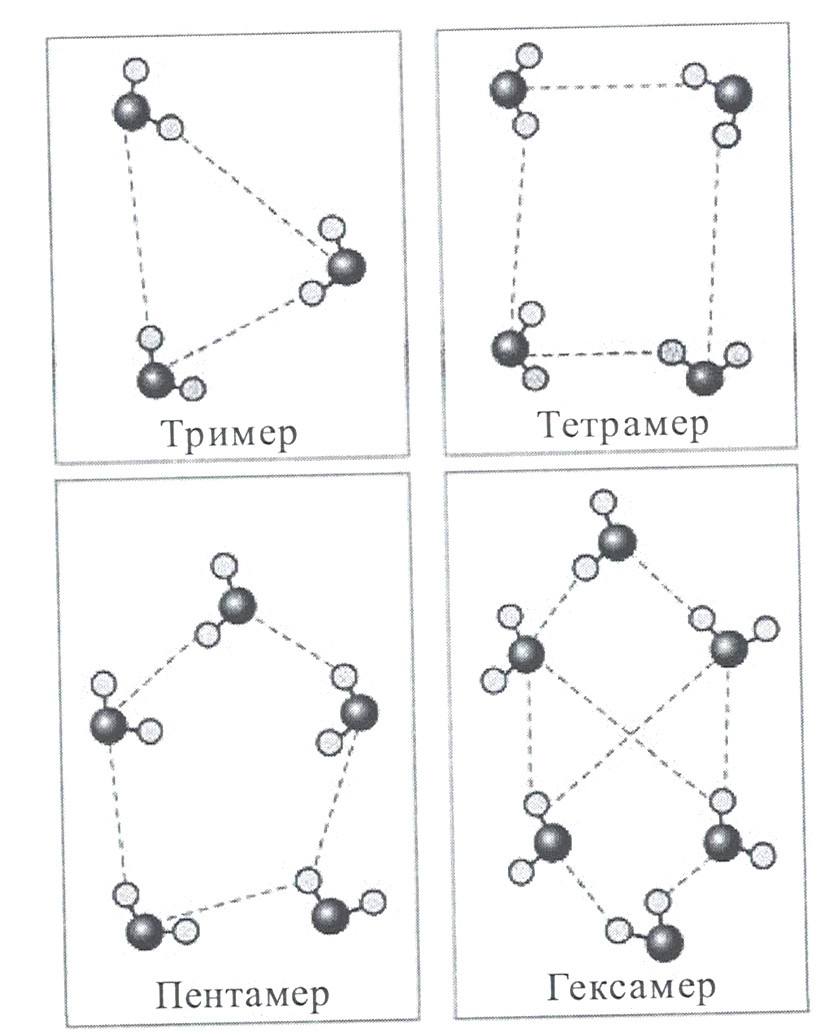
Рисунок 12 - Строение тримера, тетрамера, пентамера и гексамера-кластера воды по Р.Сейкалли.
Оригинальной кластерной моделью является теория С.В.Зенина. Согласно модели С.В.Зенина вода представляет собой иерархию геометрически правильных объемных структур "ассоциато". Согласно его теории элементарной структурной ячейкой воды являются тетраэдры, в которых может содержаться 4 (простой тетраэдр) или 5 (объемно-центрированный тетраэдр) молекул воды. При этом у каждой молекулы воды в простых тетраэдрах сохраняется способность образовывать водородные связи, благодаря чему создаются более сложные структуры, как показано на рисунке 13.
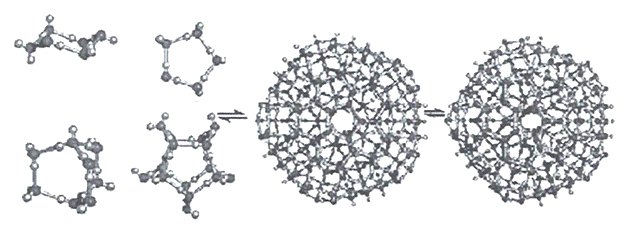
Рисунок 13 - Формирование сложных ассоциатов из молекул воды по С.В.Зенину.
Кластеры, содержащие 20 молекул воды (додэкаэдры) более стабильны. Схема их образования показана на рисунке 14.
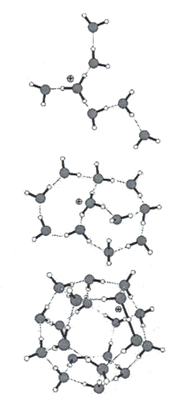
Рисунок 14 - Формирование кластеров воды из 20 молекул.
Из четырех таких образований возникают энергетически выгодные "кванты" - тетраэдрические додекаэдры (рисунок 15).
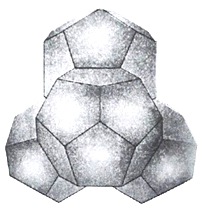
Рисунок 15 - Модель ассоциата воды из 57 молекул - "квант" (тетраэдр из четырех додекаэдров).
Из 57 молекул такого образования 17 составляют гидрофобный каркас с полностью насыщенными связями, а по 10 молекул на поверхности каждого додекаэдра формируют центры образования водородных связей.
Методами жидкостной хроматографии было подтверждено существование пяти- и шестиквантовых структур типа "четырехконечной звезды" и "шестилучевой снежинки".
При взаимодействии двух пятиквантовых фракций и одной шестиквантовой образуется кластер - ромбический куб с ребром 2,9 нм и острым углом в 60° (рисунок 16).
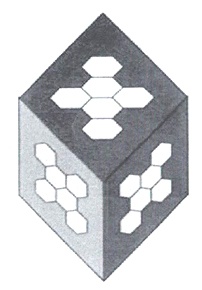
Рисунок 16 - Принципиальная модель кластера воды из 912 молекул (16 "квантов" воды).
На каждой грани такого куба существует уже по 24 центра образования водородных связей. Такой 16 квантовый куб с 912 молекулами, по Зенину, является наиболее устойчивым образованием в воде, причем их доля в структуре воды превалирует - около 80%. Еще 15% - это додекаэдрические тетраэдры, а 3-5% - неассоциированные молекулы воды. Данные цифры были подтверждены экспериментально.
На уровне 24 центров связывание по водородным связям практически прекращается ввиду того, что поверхность образований становится насыщенной (нейтральной).
Кластеры почти не взаимодействуют между собой, а скользят друг по другу, поэтому вода не отличается высокой вязкостью. В таком "режиме" из кластеров формируются метастабильные структуры, пример которых показан на рисунке 17 (микроизображение в режиме фазового контраста).
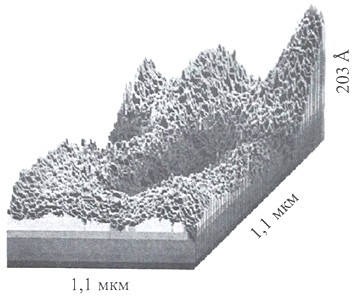
Рисунок 17 - Микроизображение объемной структуры воды.
Теория Зенина хорошо объясняет электропроводные свойства воды, уменьшение плотности при плавлении, но плохо согласуется с большими значениями коэффициента самодиффузии и малым временем диэлектрической релаксации.
Интересно, что по мнению Зенина, если степень возмущения структурных элементов воды недостаточна для перестройки всей структуры, то после снятия возмущения система релаксирует 30-40 минут до возвращения в исходное состояние. Если же переход к другому взаимному расположению структурных элементов воды оказывается энергетически выгодным, то оказанное воздействие отразится на новом состоянии.
Альтернативную, но похожую теорию выдвинул М.Чаплин. В его теории структурные элементы - это икосаэдры. По результатам расчетов Лободы и Гончарука кластеры показывают повышение устойчивости в ряду (H2O)20 < (H2O)100 < (H2O)280. Кластеры из 100 молекул могут образовывать цепочки с уменьшенными напряжением и степенью деформации водородных связей. В дальнейшем теоретически формируются сети, как показано на рисунке 18.
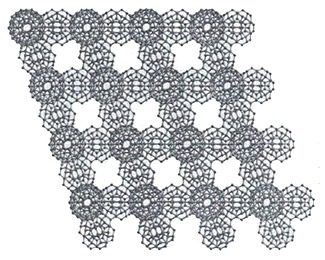
Рисунок 18 - Формирование упорядоченной сети кластерных образований икосаэдрической формы, формирующих структуру воды. Компьютерные расчеты. Показаны только атомы кислорода.
Однако практически существование регулярных матриц в воде маловероятно. Кластеры из 280 молекул также могут формировать цепочки, но с более напряженными водородными связями.
Кластеры могут разрастаться в суперкластеры (гигантские икосаэдры), примеры которых приведены на рисунке 19.
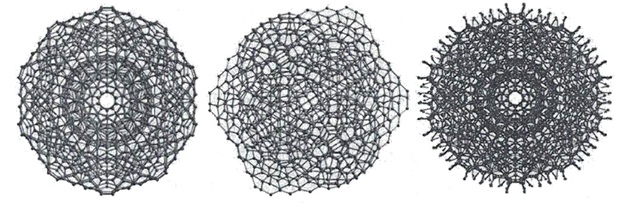
Рисунок 19 - Гигантсские икосаэдры из молекул воды по М.Чаплину.
В 2002 Беркли методом рентгеноструктурного анализа показала, что молекулы воды действительно способны образовывать структуры, представляющие собой топологические цепочки и кольца из множества молекул.
А.Н.Смирновым в бидистиллированной воде и некоторых растворах методами акустической эмиссии, лазерной интерферометрии и термического анализа удалось визуализировать надмолекулярные образования с размерами частиц от 1 до 100 мкм, распределенных в водной среде (рисунок 20). Свойства таких частиц были сходны со свойствами частиц, образующих эмульсию, поэтому они были названы "эмулонами".

Рисунок 20 - Влияние температуры на структуру воды по данным лазерной интерферометрии: а - температура 4о С, б - 20° С, в - 75°С. Микроизображения 2х2 мм.
Размеры и пространственная организация эмулонов зависят от состава водного раствора, температуры и предыстории раствора. Наибольшее число фракций имеют размеры 30, 70 и 100 мкм.
Температурная динамика структуры эмулонов имеет следующие отсечки:
- При 4° С комплексы плотно упакованы и напоминают паркет. При этой температуре вода имеет наибольшую плотность.
- При 20° С количество свободных эмулонов становится наибольшим.
- При 36° С часть эмулонов разрушается, наблюдается минимальная теплоемкость воды.
- При 63° С еще большая часть эмулонов разрушается, наблюдается минимальная сжимаемость воды
- К 75° С максимальное число эмулонов разрушается, наблюдается максимальная скорость звука в воде.
Таким образом, с рассмотренной точки зрения жидкая вода - это дисперсная система, каждая форма которой существует в определенном температурном диапазоне.
3.2 Клатратная модель строения жидкой воды.
Как уже упоминалось ранее, наряду с кластерной развивалась клатратная теория, основоположником которой в 1946 году стал О.Я.Самойлов. Он представлял структуру жидкой воды льдоподобной, полости которой частично заполнены мономерами (одна полость - одна молекула воды). Каркас структуры нарушен тепловым движением молекул.
Клатраты в целом (не только вода) делятся на два класса, зависящие от соединения-хозяина. Молекулярные клатраты образуются "хозяевами", имеющими внутримолекуярные полости. Такие клатраты могут существовать как в растворе, так и в кристаллическом состоянии. Если "хозяин" способен образовывать только межмолекулярные или кристаллические полости, то из него получаются решетчатые клатраты (рисунок 21), устойчивые лишь в твердом состоянии.

Рисунок 21 - Гидрат метана - пример решетчатого клатрата.
В поздних модификациях клатратной модели воды допускается образование водородных связей между молекулами в каркасе и молекулами в пустотах. При этом сами молекулы в обеих микрофазах соединены водородными связями.
В заключение отметим, что существует целый ряд воздействий, которые могут приводить к определенному структурированию воды:
- Сверхкритические температуры и давления;
- Магнитные и электромагнитные поля, акустические и вибрационные воздействия с определенными характеристиками;
- Растворение электролитов, образующих при диссоциации ионы с относительно малым радиусом и большим зарядом;
- Растворение неэлектролитов, вызывающих явление гидрофобной гидратации;
- Длительный контакт с поверхностью нерастворимых в воде минералов, таких, как кварц.
Возможность такого рода воздействий обуславливается тем, что вода - очень чувствительная система множества метастабильных состояний. Вода, по сути, может откликаться на воздействия практически любой природы.
Более подробно структурирование воды под воздействием внешних сил будет рассмотрено в отдельной статье.
4. Особенности строения воды в твердом виде. Лед.

• Всего насчитывается около 15 структурных модификаций льда (рисунок 22).
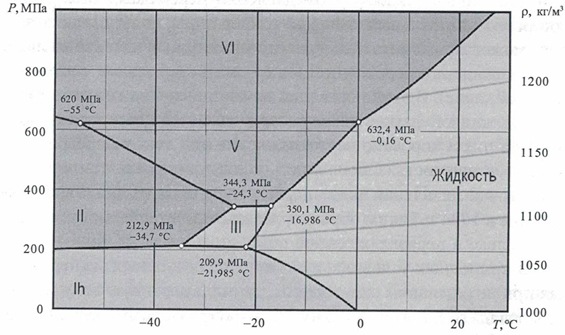
Рисунок 22 - Фрагмент фазовой диаграммы воды.
• Основные вехи в раннем исследовании льда:
1912 г. - Джонстон определил электропроводность льда.
1918 г. - А.Джоном получены первые результаты по рентгеноструктурному исследованию льда. Джон отметил, что лед собран из прямых треугольных призм.
1921 г. - Д.Деннисон уточняет это предположение.
1922 г. У.Г.Брэгг в статье "Кристаллическая структура льда" пытается выяснить причины возможных ошибок при расшифровке положений ядер кислорода. Он убежден, что ни Джон, ни Деннисон не смогли найти истинного расположения ядер кислорода в структуре льда. Брэгг сделал важное замечание: каждый атом кислорода в структуре льда должен быть окружен четырьмя другими. Атом же водорода располагается между двумя кислородами как бусинки на нитке. При этом, что важно, бусинки сдвинуты, смещены, относительно центра льда. Т.е. ядра водорода расположены асимметрично.
1929 г. - В.Варне обнаружил, что молекулы во льду полностью ионизированы, а каждый водород находится на равном расстоянии между двумя соседними ядрами кислорода. Он заявил о трехмерности каркаса льда, который должен иметь форму тетраэдра. В нем каждый атом кислорода окружен еще четырьмя, т.е молекула воды имеет четырех соседей. Однако. ни Брэгг ни Бранс не предполагали, что пространственная структура льда (как и жидкой воды) обуславливается распределением зарядов в молекулах воды.
1924, 1952, 1953 гг. - Исследована диэлектрическая постоянная льда Эррером, Оти и Коулом, Хамбеллом. Установлена ее анизотропия при 0° С.
Кристаллическая решетка льда называется ажурной (рисунок 23). Паутина связей между молекулами воды во льду содержит много крупных пустот, больших по размеру, чем сами молекулы. Именно поэтому лед более легкий, чем жидкая вода. При плавлении льда водородные связи начинают разрушаться и в пустотах оставшихся ассоциатов поместиться освободившиеся молекулы воды.
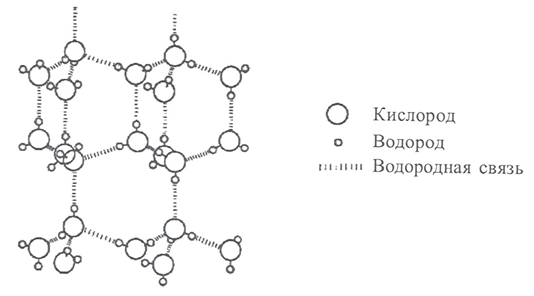
Рисунок 23 - Тетраэдрическое окружение молекул воды в кристалле льда.
• При давлении в 2 ГПа можно получить лед со структурой VI (горячий лед), который не будет плавиться даже при 80° С.
• При очень высоких давлениях внутри нанотрубок с диаметром от 1,35 до 1,90 нм вода может кристаллизоваться в форме двойных спиралей (рисунок 24).
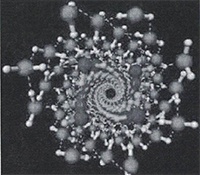
Рисунок 24 - Изображение структуры льда в нанотрубках.
• Современные представления о структуре льда говорят о наличии кластерного строения. Чем ниже температура, тем крупнее кластеры. Наиболее устойчивы кластеры из 8, 12, 24, 36 молекул.
5. Особенности строения воды в газообразном виде. Пар.

В паре водородные связи на 99% разорваны. При этом в нем сохраняется до 1% димеров. Полностью разорвать все связи в паре можно лишь при температура 600° С.
Расстояние между молекулами во много раз больше самих молекул. При этом сами молекулы хаотично двигаются, сталкиваются со стенками сосуда, в котором заключены, и между собой. Скорость их тем выше, чем выше температура системы.
Вода может длительное время находиться и в перегретом состоянии до 200° С. При введении пузырька воздуха в такую перегретую воду она мгновенно вскипает и ее температура падает до 100° С.
Продолжение статьи:
Физические и химические свойства воды. Факты о воде и аномалиях ее поведения.
Читайте также статьи
Влияние хрома на организм
Воздействие хрома на организм человека. Польза и вред.
Влияние меди на организм
Воздействие меди на организм человека. Польза и вред.
Что такое гальваника?
Теоретические основы нанесения гальванических и химических покрытий.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



