

Физические и химические свойства воды. Факты о воде и аномалии ее поведения, о которых Вы не знали
Содержание:
1. Введение.
Сегодня каждый человек знает, что самым распространенным веществом на Земле является вода. Любой без труда назовет ее химическую формулу - H2O. Однако, окунувшись чуть глубже в вопрос строения и свойств воды, водных растворов, оказывается, что вода таит в себе множество неразрешенных вопросов и аномалий. Эти вопросы могут интересовать ученых, производственников, медиков. Эти же вопросы должны быть интересны каждому человеку, ведь мы по большей части состоим из воды. Так, интересно понять:
- Каковы современные представления о структуре воды. Особенно - есть ли у воды "память" не в мистическом, а в строго научном смысле;
- Вода, которую мы пьем - по сути разбавленный раствор. Что это и как концентрация веществ в растворе может влиять на его биологическую активность?
- Как внешние физические факторы, окружающие нас, могут влиять на воду и водные растворы, из которых в т.ч. состоит человек.
- Как вода, поступающая в организм, в зависимости от химического состава влияет на него? Какую воду можно пить?;
- Как лучше произвести очистку воды в домашних условиях.
2. Немного фактов о воде.
- С точки зрения названия вода имеет много синонимов: оксид водорода, гидроксид водорода, монооксид дигидрогена, оксидан, дигидромонооксид, гидрид кислорода.
- В малом объеме вода бесцветна. Толстые же слои воды имеют голубовато-зеленую окраску.
- На нашей планете около 16 млрд. км3 воды - это 0,25% массы Земли. Из них 0,2 млрд. км3 - озера и реки, 13 тыс. км3 - водяной пар атмосферы.
- 97,6% известной свободной воды содержится в Мировом океане. В мантии Земли воды еще в 10-12 раз больше, чем в океане.
- Человек в среднем состоит на 70% из воды, медуза - на 96%, а водоросли - на 99%. В младенце содержится значительно больше воды, чем в человеке преклонных лет.
- В костях человека содержится 22% воды, в крови - 83%, в стекловидном теле глаз - 99%.
- Человек в некотором смысле является гидравлической машиной, поэтому застой жидкости в разных частях организма или преграды для ее свободного перемещения обязательно вызывают заболевания.
- За год через организм человека проходит около 1 тонны воды.
3. Свойства воды.
3.1 Некоторые физические свойства.
• Зависимость относительного объема воды от температуры:
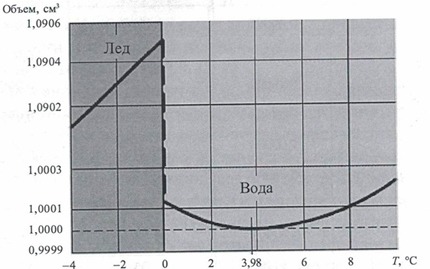
• Зависимость плотности массы воды от температуры:
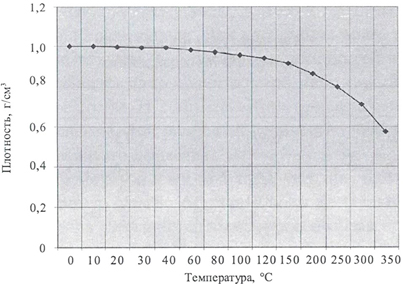
• Зависимость динамической вязкости воды от температуры.
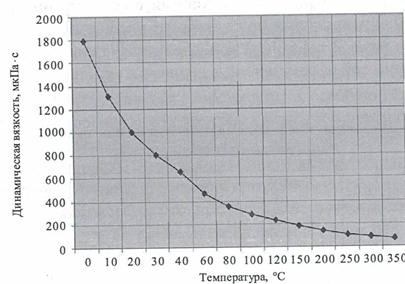
• Зависимость коэффициента теплопроводности воды от температуры.
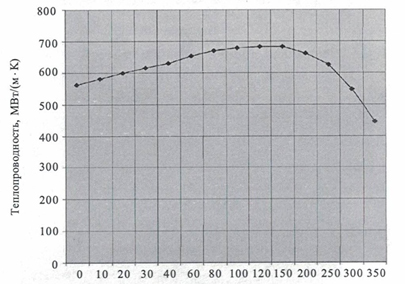
3.2 Важнейшие химические свойства воды.
- При температуре выше 100° С вода постепенно начинает разлагаться на водород и кислород.
- Полярные молекулы воды связываются с ионами и молекулами (сольватируют), образуют гидраты и кристаллогидраты.
- Многие оксиды, соединяясь с водой образуют кислоты и основания.
- Наиболее активные металлы взаимодействуют с водой с выделением водорода.
- Вода взаимодействует со фтором и межгаллоидными соединениями, с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз; с ангидридами и галогенангидридами карбоновых и неорганических кислот; с активными металлоорганическими соединениями (диэтилцинк, реактив Гриньяра, метилнатрий и т.д.); с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (Ca, Na, Li и др.); с боранами, силанами, кетенами, фторидами благородных газов.
- При нагревании вода реагирует с Fe, Mg, C, CH4, с некоторыми алкилгалогенидами.
- Вода - катализатор некоторых реакций, например, реакции Cl2 с металлами.
- Вода вступает в реакции с амидами, эфирами карбоновых кислот, ацетиленом и другими алкинами, алкенами, нитрилами на катализаторах.
- Вода образует клатраты - соединения без химических связей. Так вода реагирует с газами, которые заполняют полости в ее структуре.
- Важнейшая реакция воды - синтез крахмала растениями с выделением O2.
3.3 Аномалии воды.
Почти все физико-химические свойства воды представляют исключения в сравнении с гидратами элементов VI группы. Вероятно, именно благодаря этому стала возможна жизнь:
• При замерзании вода расширяется, а не сжимается, как все другие жидкости. Лед со структурой Ih (см. фазовую диаграмму льда, рисунок 22) при одинаковом давлении имеет на 10% меньшую плотность, чем жидкая вода. Именно поэтому айсберги способны плавать. Большая часть льда на земле имеет Ih-структуру. Благодаря этому зимой верхние слои водоемов не смешиваются и вода в них не промерзает на всю глубину вместе со всеми обитателями. И все же есть небольшое количество "тяжелого" льда Ic тонущего в жидкой воде.
• С ростом давления на каждые 130 атм. температура замерзания воды уменьшается на 1о С. Поэтому вода в жидком виде существует на больших глубинах в морях при температурах значительно ниже 0°С.
• Cогласно периодическому закону Д.И.Менделеева в ряду гидридов серы, селена и теллура вода должна была бы иметь температуру замерзания -90° С, а кипения - плюс 70° С, что, как мы знаем, не так.
• Удельная теплоемкость воды в 5-10 раз выше, чем у других природных веществ. Теплоемкость лития и древесины приближается к воде и лишь у аммиака она выше. Благодаря высокой теплоемкости вода является мощнейшим энергоносителем и регулятором температуры поверхности на Земле. Вода медленно охлаждается ночью и медленно нагревается днем. Аналогично при смене времен года. Для того, чтобы испарить 1 г воды требуется 537 калорий. Если бы водородные связи у воды были сильнее или слабее, то картина нашего мира была бы совершенно иной.
• Удельная теплоемкость воды уменьшается при повышении температуры от 0 до 37° С, тогда как у других веществ (кроме ртути, где идет монотонное уменьшение) она увеличивается. Выше 37° С теплоемкость воды увеличивается, как и положено жидкостям. Только у воды есть "температурная яма" при 37° С, в которой она быстрее всего нагревается и охлаждается благодаря минимальной теплоемкости. Заметим, что температура тела человека равна 36,6° С, т.е. организм человека, как водная система, как раз и находится практически в это "яме". В жидком виде вода в 2 раза более теплоемка, чем лед или пар.
• Плотность дистиллированной воды при нагреве от 0 до 100° С проходит через максимум при 4° С. У других жидкостей плотность при нагревании монотонно уменьшается.
• Воду можно переохладить до температур значительно ниже точки плавления льда, сохранив ее при этом в жидком виде. Вообще, ледовые кристаллы могут образоваться только в метастабильной "переохлажденной" воде. В природе и лаборатории дистиллированная вода может достичь глубокого переохлаждения при условии полной ее неподвижности и отсутствия центров кристаллизации - пылинок, кристалликов льда и т.п. Так, дегазованная дистиллированная вода может быть переохлаждена до -70° С. Но от легкого встряхивания или попадания пылинки такая вода мгновенно превращается в лед.
При -50° С вода может существовать в виде мельчайших капель и внутри тонких капилляров.
При -30° С вода в жидком виде может находиться в облаках.
• Нагретая вода замерзает быстрее охлажденной, что не находит пока строгого и убедительного объяснения (парадокс Мпембы).
• Удельная теплота плавления льда необыкновенно высокая. Вода и лед при 0о С различаются между собой по содержанию скрытой энергии на 333*103 Дж. С повышением температуры удельная теплота плавления не увеличивается, а уменьшается на 2,1 Дж/°С.
• Вязкость воды при температурах ниже 30° С имеет параболическую зависимость от давления. Для всех веществ вязкость уменьшается с ростом температуры и увеличивается с ростом давления.
• В капиллярах, диаметр которых близок к 10-9 м, вода резко увеличивает вязкость, уплотняется в 1,5 раза и замерзает при температурах ниже минус 73° С. Молекулы воды в нанотрубках при температуре минус 23° С и давлении 40000 атм. выстраиваются в спиральные "лесенки", напоминающие двойные спирали.
• Диэлектрическая проницаемость у воды чрезвычайно велика, наивысшая, среди жидкостей и равна 81 (у льда при минус 5° С она равна 73). У большинства жидкостей она равна 2-8 и лишь у некоторых спиртов - 27-35. Вследствие этого вода обладает большей растворяющей способностью, чем другие жидкости.
• Коэффициент преломления света водой равен 1,333 для длины волны 580 нм при температуре плюс 20° С, вместо требуемого теорией значения 9.
• Удельная теплоемкость водяного пара до температуры плюс 500° С отрицательна, т.е. пар при сжатии остается прозрачным, а при разрежении превращается в туман (сгущается).
• Удельная теплота парообразования воды при понижении температуры увеличивается, достигая при 0° С очень высокого значения 25*105 Дж/кг.
• Вода обладает самым высоким, за исключением ртути, поверхностным натяжением среди жидкостей (0,0727 Н/м при 20° С). Связанное с ним явление капиллярности очень важно для объектов биосферы.
• Существовали исследования "четвертой фазы воды". Так, известный отечественный физико-химик Дерягин предположил существование "аномальной воды", имеющей плотность на 40% выше нормальной и кипящей при температуре 300° С. Позднее он опроверг свои исследования, объяснив их "неряшливо поставленными экспериментами". В то же время, американский профессор Д.Поллак также говорил об "аномальной воде".
Строение молекулы и структура воды в жидком, твердом и газообразном виде.
Читайте также статьи
Влияние хрома на организм
Воздействие хрома на организм человека. Польза и вред.
Влияние меди на организм
Воздействие меди на организм человека. Польза и вред.
Что такое гальваника?
Теоретические основы нанесения гальванических и химических покрытий.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



