

Переработка медной стружки с получением товарных продуктов
Вторая часть этой статьи:
Переработка медной стружки с получением товарных продуктов (ч.2) - Существующие технологии и выводы
Содержание:
1.1 Общая информация по меди, ее сплавам и соединениям.
1.2 Краткие химические свойства цинка.
1.3 Краткие химические свойства свинца.
1.4 Краткие химические свойства никеля.
2. Физико-химические основы растворения меди и кристаллизации медного купороса.
2.1 Физико-химические основы растворения меди и ее сплавов в сернокислом растворе.
2.2 Коррозионные и анодные процессы на сплавах меди.
2.3 Теоретические основы электролиза меди.
2.4 Теоретические основы цементации металлов.
2.5 Теоретические основы кристаллизации металлов из водных растворов.
Медная, латунная и бронзовая стружка может быть переработана пирометаллургически и гидрометаллургически. В первом случае это переплавка, во втором — химическая переработка.
Сложность первого метода состоит в том, что при переплавке часть меди и еще большая часть цинка выжигаются, что приводит как к экономическим безвозвратным потерям, так и к экологическому ущербу и ухудшению условий труда. В таблице 1 приведены наиболее высокие закупочные цены на стружку, которая перерабатывается именно по первой технологии (открытые материалы из интернета).
|
Наименование |
Цена до 100 кг |
Цена 100-500 кг |
Цена 500-1000 кг |
Цена свыше 1000 кг |
|
Медьсодержащая стружка |
153 |
165 |
168 |
170 |
|
Латунная стружка |
84 |
91 |
92 |
93 |
Представляет интерес второй способ, который не требует столь больших капитальных вложений. Однако главная сложность метода заключается в том, что необходимо разделять двух-трех компонентные сплавы, обладающие по отдельности низкой реакционной способностью. Разделение можно провести двумя путями - химическим и электрохимическим. В первом случае мы используем только химические реакции и можем воздействовать на систему (ускорять реакцию):
- изменением температуры
- введением окислителя
- введением катализаторов
Во втором случае мы можем использовать анодную поляризацию сплава для ускорения растворения, в совокупности с описанными выше способами.
В обеих методиках приходится столкнуться с тем, что физико-химические закономерности процессов не до конца исследованы, а описанные в литературе механизмы реакций оказываются гораздо сложнее.
Выбор растворителя (выщелачевателя) является первоочередной задачей. Для этого необходимо знать химические свойства компонентов, содержащихся в перерабатываемых сплавах.
1.1 Общая информация по меди, ее сплавам и соединениям
Плотность меди — 8,93*103кг/м3, удельная теплоемкость при 20°C - 0,094 кал/град, температура плавления - 1083°C, удельная теплота плавления - 42 кал/г, температура кипения - 2600°C, коэффициент линейного расширения (при температуре около 20°C) - 16,7 *106(1/град), коэффициент теплопроводности меди - 335ккал/м*час*град, удельное сопротивление при 20°C - 0,0167 Ом*мм2/м.
качество катодной меди регламентируется ГОСТ 546 «Катоды медные». По химическому составу катодная медь классифицируется по ГОСТ 859. Содержание меди после электролитического рафинирования из сульфатного электролита должно составляет 99,99%.
Сплавы, повышающие прочность и другие свойства меди, получают введением в нее добавок, таких, как цинк, олово, кремний, свинец, алюминий, марганец, никель. На сплавы идет более 30% меди. Латуни - сплавы меди с цинком (меди от 60 до 90% и цинка от 40 до 10%) - прочнее меди и менее подвержены окислению. При присадке к латуни кремния и свинца повышаются ее антифрикционные качества, при присадке олова, алюминия, марганца и никеля возрастает антикоррозийная стойкость.
Раньше бронзами называли сплавы меди (80-94%) и олова (20-6%). В настоящее время производят безоловянные бронзы, именуемые по главному вслед за медью компоненту.
Медный купорос или серно-медная соль CuSO4.5H2O - встречается в природе как вторичное образование, в виде кристаллов и натечных масс, или в виде раствора, в так называемых цементных водах.
Состав медного купороса регламентируется двумя документами - ГОСТ 19347-99 и ТУ 2141-368-100-97. Состав по ГОСТ приведен в таблице 2. Текст ГОСТа вынесен в приложение 1.
|
|
Норма для марки |
||||
|
А |
Б |
||||
|
Высший сорт |
Первый сорт |
Высший сорт |
Первый сорт |
Второй сорт |
|
|
CuSO4 * 5H2O, не менее, в пересчете на Cu |
99,1
25,22 |
98
24,94 |
98,1
24,97 |
96
24,43 |
93,1
23,96 |
|
Железо (Fe) не более |
0,02 |
0,04 |
0,04 |
0,05 |
0,10 |
|
Свободная серная кислота, не более |
0,20 |
0,25 |
0,20 |
0,25 |
0,25 |
|
Нерастворимый в воде осадок |
0,03 |
0,05 |
0,05 |
0,05 |
0,10 |
|
Мышьяк, не более |
0,002 |
0,012 |
0,012 |
0,012 |
0,028 |
|
Примечания 1. Для сельского хозяйства и в розничную торговлю поставляется медный купорос марок А и Б высшего и первого сорта 2. В медном купоросе марки А высшего сорта, предназначенном для экспорта, массовая доля кальция должна быть не более 0,006%, массовая доля магния - не более 0,005%. |
|||||
Медный купорос применяется в сельском хозяйстве в качестве фунгицида, в промышленности в производстве искусственных волокон, красителей, минеральных красок, мышьяковистых химикатов, для обогащения руды при флотации.
Химические свойства меди детально рассмотрены в главе 2. Свойства легирующих элементов кратко приведены ниже.
1.2 Краткие химические свойства цинка
Нормальный окислительно-восстановительный потенциал цинка равен -0,76 В. На воздухе при температуре до 100°С цинк быстро тускнеет, покрываясь поверхностной пленкой основных карбонатов. Во влажном воздухе, особенно в присутствии СО2, происходит разрушение металла даже при обычных температурах. Сульфид цинк выпадает в осадок при действии сероводорода на слабокислые или аммиачные водные растворы солей Zn. Сильные минеральные кислоты энергично растворяют цинк, особенно при нагревании, с образованием соответствующих солей. При взаимодействии с разбавленной НCl и H2SO4 выделяется Н2, а с НNО3 - кроме того, NO, NO2, NH3. С концентрированной НCl, H2SO4 и HNO3 цинк реагирует, выделяя соответственно Н2, SO2, NO и NO2. Растворы щелочей окисляют цинк с выделением Н2 и образованием растворимых в воде цинкатов. Интенсивность действия кислот и щелочей на цинк зависит от наличия в нем примесей. Чистый цинк менее реакционноспособен по отношению к этим реагентам из-за высокого перенапряжения на нем водорода. В воде соли цинка при нагревании гидролизуются, выделяя белый осадок гидрооксида Zn(OH)2. Известны комплексные соединения, содержащие Цинк, например [Zn(NH3)4]SО4 и другие.
1.3 Краткие химические свойства свинца
Нормальные электродные потенциалы свинца соответственно равны -0,126 В для Рb/Рb2+ и +0,65 В для Pb/Pb4+. Однако свинец не вытесняет водород из разбавленной соляной и серной кислот, вследствие перенапряжения Н2 на Pb, а также образования на поверхности металла защитных пленок трудно-растворимых хлорида РbCl2 и сульфата PbSO4. Концентрированные H2SO4 и НCl при нагревании действуют на Pb, причем получаются растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, уксусная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с образованием солей Рb (II). По растворимости в воде соли делятся на растворимые (ацетат, нитрат и хлорат свинца), малорастворимые (хлорид и фторид) и нерастворимые (сульфат, карбонат, хромат, фосфат, молибдат и сульфид). Соли Pb (IV) могут быть получены электролизом сильно подкисленных H2SO4 растворов солей Рb (II); важнейшие из солей Pb (IV) - сульфат Pb(SO4)2 и ацетат Рb(С2Н3О2)4. Соли Pb (IV) склонны присоединять избыточные отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4].
1.4 Краткие химические свойства никеля
Нормальный водородный потенциал никеля равен -0,24 В. По отношению к воде никель устойчив. Органические кислоты действуют на никель лишь после длительного соприкосновения с ним. Серная и соляная кислоты медленно растворяют никель, разбавленная азотная - очень легко, концентрированная HNO3 пассивирует никель, однако в меньшей степени, чем железо. При взаимодействии с кислотами образуются соли Ni (II). Почти все соли Ni (II) и сильных кислот хорошо растворимы в воде, растворы их вследствие гидролиза имеют кислую реакцию. Труднорастворимы соли таких сравнительно слабых кислот, как угольная и фосфорная. Большинство солей никеля разлагается при прокаливании (600 - 800 °C). Одна из наиболее применяемых солей - сульфат NiSO4 кристаллизуется из растворов в виде изумрудно-зеленых кристаллов NiSO4·7H2O - никелевого купороса. Сильные щелочи на никель не действуют, но он растворяется в аммиачных растворах в присутствии (NH4)2CO3 с образованием растворимых аммиакатов, окрашенных в интенсивно-синий цвет; для большинства из них характерно наличие комплексов [Ni(NH4)6]2+ и [Ni(OH)2(NH3)4]. На избирательном образовании аммиакатов основываются гидрометаллургические методы извлечения никеля из руд.
2. Физико-химические основы растворения меди и кристаллизации медного купороса
В настоящее время не существует единой теории химического и электрохимического растворения металлов, в том числе и меди, не разработана общая концепция, связывающая процессы, протекающие в жидкой фазе и на поверхности раздела «металл - раствор». Является актуальным дальнейшее развитие теории пассивации, так как при химическом и электрохимическом растворении меди создаются условия для формирования на поверхности твердой фазы из малорастворимых соединений Cu(I) и Cu (II), препятствующих дальнейшему растворению металла. До настоящего времени являются актуальными вопросы влияния физико-химических факторов на скорость химического растворения металлов и сплавов, не решены вопросы взаимосвязи состава комплексов меди и их реакционной способности (либо каталитической активности) по отношению к процессу растворения меди.
2.1 Физико-химические основы растворения меди и ее сплавов в сернокислом растворе
Медь в концентрированной серной кислоте растворяется только при нагревании по уравнению:
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 (1)
Кроме указанной основной, здесь происходят еще побочные реакции: в начале действия кислоты появляется светло-бурый осадок Cu2S, который сразу переходит в черный 2Cu2S.CuO, затем 2CuS.CuO и, наконец, CuS.CuO.
При взаимодействии меди с разбавленным раствором серной кислоты, содержащим также сульфат меди, в присутствии воздуха, кислород воздуха растворяется в кислоте, диффундирует к поверхности меди и окисляет ее до закиси меди:
4 Cu + O2 = 2 Cu2O (2)
Закись меди растворяется в серной кислоте:
Cu2O + H2SO4 = Cu2SO4 + H2O (3)
Образующийся сульфат закиси меди легко окисляется в сульфат окиси меди:
2 Cu2SO4 + 2 H2SO4 + O2 = 4 CuSO4 + 2H2O (4)
Общая скорость процесса лимитируется наиболее медленной его стадией — окислением меди до закиси меди. Это объясняется малой растворимостью кислорода и медленной его диффузией к поверхности гранул меди. Процесс значительно ускоряется, когда в растворе уже присутствует медный купорос.
Повышение температуры, как и в других случаях, ускоряет химические реакции, но вызывает уменьшение растворимости кислорода, что замедляет окисление.
Растворимость кислорода уменьшается с ростом концентрации CuSO4 в растворе. Поэтому при повышении концентрации CuSO4 скорость растворения меди сначала увеличивается за счет каталитического действия CuSO4, а затем уменьшается вследствие недостатка кислорода. Максимум скорости растворения наблюдается при концентрации 120 г./л CuSO4 (для раствора, содержащего ~ 110 г./л H2SO4). Но даже при содержании в растворе 300 г./л CuSO4 скорость растворения меди в 1,6 раза больше, чем в отсутствие медного купороса. С увеличением концентрации серной кислоты растворимость кислорода в ней уменьшается, но усиливаются ее окислительные свойства. Поэтому повышение кислотности раствора вызывает не очень большое уменьшение скорости растворения меди - всего на 10 % при повышении концентрации H2SO4 с 2,5 до 20 %. Растворение меди значительно ускоряется в присутствии в растворе ионов железа вследствие деполяризации:
4 Fe2+ + O2 + 4 H+ = 4 Fe3+ + 2 H2O (5)
2 Cu + 4Fe3+ = 2 Cu2+ + 4 Fe2+ (6)
Ионы Fe2+ вновь окисляются в Fe3+ и служат, таким образом, катализатором процесса. Доля растворяющейся меди под действием ионов Fe3+ в растворе, содержащем ~110 г./л H2SO4, 60 г./л CuSO4 и 20 - 22 г./л FeSO4, составляет около 60 % от всего количества меди, перешедшей в раствор.
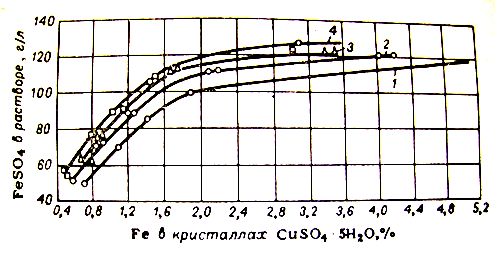
Рисунок 1 — Зависимость между содержанием FeSO4 в растворе медного купороса и содержанием железа в кристаллах CuSO4*5H2O. Содержание CuSO4* 5H2O в растворе (г/л): 1 - 400; 2-500; 3-550; 4-600.
Концентрация сульфата железа не должна превышать в среднем 40 г./л, чтобы не получился продукт не соответствующий ГОСТу по содержанию железа (см. рисунок 1).
Существенным является обеспечение равномерного орошения (смачивания) гранул меди раствором. В местах, плохо орошаемых кислотой, образовавшаяся окисная пленка растворяется не полностью, вследствие малой своей растворимости кристаллизуется из раствора и цементирует при этом гранулы и шлам.
2.2 Коррозионные и анодные процессы на сплавах меди.
При растворении сплавов каждый компонент проявляет собственные электрохимические свойства. Из медных сплавов наиболее изучены латуни. В работе показано, что возможно как селективное растворение (СР) Zn с обогащением поверхностного слоя медью, так и равномерное растворение обоих компонентов с последующим восстановлением меди на поверхности латуни. Анодное растворение латуней обычно отличается от коррозионного отсутствием псевдоселективного растворения. Повышенные значения коэффициента селективности Zn (ZZn) и более ранний переход от СР к равномерному наблюдаются с ростом j. ZZn снижается во времени и при перемешивании раствора. В результате СР на поверхности латуни образуется тонкий обедненный цинком слой.
Равномерному растворению латуней способствуют сдвиг потенциала в анодную область и наличие в коррозионной среде окислителя. Соотношение Сu+/Сu2+ зависит от рН раствора: при малых рН доля ионов Сu+ мала, в щелочных растворах эта величина возрастает. В работе показано, что в аммиачных растворах на .-латуни возможно образование поверхностного слоя Сu2О, а СuСl на Сu38Zn — латуни в боратном электролите.
Проведены исследования по ионизации сплава Л-62 в концентрированных растворах FeCl3, CuCl2 и в водно-ацетонитрильных растворах. При растворении Л-62 в растворах хлоридов происходит селективное растворение цинка, процесс контролируется растворением меди. Растворение латуни лимитируется диффузией продуктов в объем раствора. Обогащение поверхности медью более интенсивно в меднохлоридных растворах, что объясняется протеканием реакции контактного обмена. Поверхностными фазами являются слой, обогащенный медью, и CuCl. Замена части FeCl3 на CuCl2 интенсифицирует растворение латуни.
При анодном растворении латуни в водно- ацетонитрильных растворах до определенной концентрации ацетонитрила (70% мас.) увеличивается скорость ионизации сплава. Контролирующей стадией процесса является катодная. Обесцинкование, характерное для смесей с малой концентрацией ацетонитрила, быстро уменьшается во времени, сменяясь равномерным растворением латуни. В результате прямой ионизации Zn и Cu до ионов Zn (II) и Cu (II) (для медной составляющей двухэлектронная ионизация характерна для концентрированных растворов ацетонитрила), а также в результате реакций репропорционирования между ионами Cu (II) и участками, обогащенными медью, контактного обмена:
Zn + 2Cu2+ → Zn2+ + 2Cu+ (54)
и образуется совокупность ионов цинка и меди как растворимых продуктов электрохимической коррозии, а также нерастворимые продукты — ZnO, CuCl и в меньшем количестве CuOH, Cu(OH)2, Zn(OH)2. Увеличение концентрации ацетонитрила вызывает исчезновение ионов Cu (I), образующихся в смесях, богатых ацетонитрилом, по реакциям репропорционирования и контактного обмена. Для медно - никелевых сплавов в начальный период растворения характерно СР никеля с последующим переходом к равномерному растворению при более длительной поляризации. Содержание Ni в поверхностной зоне (3-4 атомных слоя) понижается на ~ 30 %. Интегральный коэффициент селективности составляет 47, причем при анодном растворении из общего количества электричества на растворение Ni расходуется 70-80 %, а на Сu - только 10 %.
В работе исследована коррозионная стойкость сплавав Сu - Ni с различным содержанием никеля. Граница стойкости наблюдается при 50 ат. % Ni, а граница скорости коррозии - при 31-37 ат. % Ni. Показано превышение нестационарного анодного тока у сплава Сu30Ni по сравнению с Сu10Ni.
Зависимость скорости электрорастворения сплава от ССl- варьирует с его составом. Определена критическая ССl-, ниже которой сопротивление коррозии возрастает с уменьшением содержания Ni в сплаве, а выше — с его увеличением. В отсутствие сильных окислителей (Fе3+) анодный процесс контролируется диффузией, а катодный — переносом заряда. Введение в электролит ионов Fе3+ изменяет контроль стадий: анодная лимитируется переносом заряда, а катодная — диффузией. В хлорид - содержащих растворах Сu - Ni сплавы могут пассивироваться соединениями СuСl, Сu2О и Сu2(ОН)3Сl.
В работах на примере сплавов МН19, МНЖ Мц 30-0.8-1, МН Мц 40-1.5, МН Мц 43-0.5 было изучено коррозионное и анодное поведение Сu - Ni систем в кислых хлоридных и аммиачных растворах. Селективность растворения сплавов определятся как природой раствора, так и содержанием Ni в сплаве. В хлоридной среде сплавы с содержанием Ni до 29 % мас. активно растворяются с образованием ионов Ni(II) и Cu(I). Поверхность сплава обогащается CuCl и медью. При более высоком содержании Ni анодное растворение сплавов лимитируется растворением никеля. Такие сплавы обладают высокой поляризуемостью, характерной для пассивного состояния. При высокой анодной поляризации резкое увеличение тока сопровождается разрыхлением поверхности. Предварительная выдержка сплавов с высоким содержанием Ni в растворах NaCl активирует поверхность, вероятно, за счет специфической адсорбции Cl- ионов в широком диапазоне потенциалов.
Аналогичный эффект оказывает повышение температуры. Растворенный кислород переводит сплавы в пассивное состояние. Коррозионное поведение в аммиачных растворах, подобно анодному, определяется содержанием Ni в сплаве: более высокое его содержание способствует быстрому обогащению поверхности сплава Ni-защищающим компонентом. С увеличением времени травления повышается вероятность перехода в разряд стойких сплавов с меньшим содержанием Ni. Анодное растворение вызывает появление пассивирующего соединения NiO только у сплавов с содержанием Ni 43.5 %, причем тем быстрее, чем выше концентрация NH3. С целью выяснения возможности электролитического получения гидроксидов меди и железа как основы для производства ферритов в работах изучено влияние компонентов сплавов на электрохимическое поведение системы Fe-Cu в щелочных растворах и природа пассивирующих соединений. В области высоких поляризаций основными пассивирующими соединениями сплавов являются Cu(OH)2, Fe(OH)2 и Fe(OH)3. Область пассивации глубокая с малыми значениями тока. Присутствие хлорид -ионов снижает концентрационный барьер Fe в сплаве, при котором регистрируется пассивация, что можно объяснить активирующим действием Cl- ионов. Для сплава с 38 % мас. Fe подобран режим электролиза с получением гидроксидного сырья для синтеза моноферрита меди. Последующая его термическая обработка дает совокупность продуктов в интервале температур:
20-200 °С CuFe2O4, FeFe2O4, Cu2O
300-400 °С CuFe2O4, Cu2O
500-600 °С CuFe2O4, CuO.
Таким образом, уже в электролитической ванне начинается образование феррита CuFe2O4. Полученные теоретические результаты позволили сформулировать принципы интенсификации процессов химического травления меди, заключающиеся в создании условий, благоприятствующих для формирования в жидкой фазе каталитически — активных комплексов меди (II) и для растворения поверхностных соединений меди (I). На этой основе разработаны новые составы медно — аммиачных травильных растворов с частичной заменой ионов хлора на ионы брома и йода, а также с введением в их состав аминов. Оптимизированы составы солянокислых растворов CuСl2 с добавками ацетона или ацетонитрила. Интенсификация и совершенствование процессов травления были осуществлены и для персульфатных травильных растворов, использующихся для изготовления печатных плат с металлическими резистами. Новые технологические процессы травления позволяют значительно повысить емкость растворов по вытравленной меди, скорость травления с сохранением ее равномерности во времени при одновременном обеспечении высокого качества обрабатываемой поверхности.
2.3 Теоретические основы электролиза меди
В данном разделе рассматриваются общие электрохимические принципы анодного и катодного поведения меди при электролизе на примере сернокислого электролита. Эти закономерности являются базовыми при проектировании электрохимических методов переработки медных, латунных и бронзовых отходов.
Электролитическое рафинирование цветных металлов — разновидность процесса электролиза в водных растворах с выделением металла. Цель — рафинирование, т.е. очитка меди от примесей путем электролитического растворения загрязненной примесями анодной меди (анодный процесс) с последующим электроосаждением меди на катоде (катодный процесс). Получается чистая электролитическая медь в форме катодных отложений, а примеси концентрируются в донном шламе (драгоценные металлы, селен, теллур и т.д.) или в электролите в растворенной форме.
Электролитическое рафинирование меди происходит в электрохимической системе: электроды (медный катод - отрицательно заряженный, медный анод - положительно заряженный) и раствор электролита.
(-) Cu/CuSO4 -- H2SO4/Cu (+)
При наличии внешнего источника постоянного тока на катоде идет процесс выделения меди:
Cu2+ + 2e à Cu
на аноде, кроме растворения меди:
Cu - 2e à Cu2+
образуются примеси, переходящие в электролит или в анодный шлам.Протекание тока через электрохимическую систему вызывают качественные изменения, которые претерпевают ионы, атомы и молекулы на границе раздела фаз электрод — электролит в системе возникает перераспределение электрического заряда, образуется двойной электрический слой и возникает скачок потенциала - электродный потенциал. Нормальный (стандартный) электродный потенциал — потенциал электрода — металла, опущенного в раствор, содержащий его ионы при условии, если активность или отношение активностей ионов относительно которых электрод является обратимым, равно единице.
E0,B
Cu2+ + 2e = Cu +0.34
Cu+ + e = Cu +0.52
Электродные процессы при катодном осаждении и ионизации меди из растворов сопровождаются главным образом концентрационной поляризацией.
Поляризация — это отклонение потенциала электрода его равновесного значения при прохождении тока через электрод. Концентрационная поляризация — смещение потенциала под влиянием изменения концентрации электролита при электролизе, вызванное замедленностью доставки ионов или их отвода от поверхности электрода. Убыль концентрации ионов разряжающего металл пропорциональна всему току, проходящему через систему, а доставка их к катоду соответствует лишь доле тока, определяемой числом переноса данного иона.
При концентрационных изменениях в приэлектродном слое возникает диффузия, которая способствует выравниванию концентрации веществ. Диффузионные ограничения являются причиной торможения электродных реакций.
Равновесный потенциал электрода (Е) — скачок электрического потенциала между электродом и раствором, устанавливающийся при равенстве скоростей реакции окисления и восстановления.
Масса выделившегося на катоде металла зависит от его электрохимического эквивалента (количество вещества при прохождении через раствор электричества = 1Ач), а также от пропущенного через систему количества электричества.
Электрохимический эквивалент равен:
q = m/n*26,8
где:
m - молекулярная масса,
n - число электронов, участвующих в элементарном акте реакции.
Теоретическое количество металла выделившегося на электроде при прохождении тока через электрохимическую систему определяют по формуле:
Q=I*τ*q
Практическое количество выделившегося металла отлично от расчетного по причинам:
1. совместный разряд нескольких ионов с различной валентностью,
2. перезарядка ионов,
3. взаимодействие продуктов электродных реакций между собой или с электролитом.
Количество выделившегося металла регламентируется величиной выхода по току. Анодный выход по току больше катодного по ряду причин:
- растворение оксида меди, присутствующего в анодах огневого рафинирования:
Cu2O + 2H2SO4 + 0,5 O2 = 2CuSO4 + 2H2O
- химическое растворение меди:
Cu + H2SO4 + 0,5 O2 = CuSO4 + H2O
- окисление одновалентных ионов меди:
Cu2SO4 + H2SO4 + 0,5O2 = 2CuSO4 + H2O
Превышение анодного выхода по току приводит к накоплению меди в электролите, снижению кислотности, что требует корректировки состава электролита по основным компонентам - Cu, H2SO4 , осуществляемой либо подключением в товарных сериях ванн регенерации, либо выводом части электролита в отделение обезмеживания, для очистки меди.
Основная задача рафинирования меди — полное удаление из анодной меди примесей, условно разбиваемых по знаку электрохимического потенциала и его величине на группы:
- Ni, Fe, Zn и др., потенциалы которых электроотрицательнее меди.
- мышьяк, сурьма, висмут - потенциалы которых близки к потенциалу меди.
- драгметаллы (Ag, Au), потенциалы которых электроположительнее меди.
Ряд примесей (Se, Te, S, O2) образуют с медью нерастворимые соединения и переходят в шлам. Свинец, образующий в электролите сернокислые соли и олово, дающее в растворах основные соли, также осаждаются со шламом. Металлы (примеси) - Ni, Fe, Zn при химическом растворении переходят в раствор, накапливаются в нем и негативно влияют на процесс электрокристаллизации меди, ухудшают качество меди.
Примеси мышьяка, сурьма, висмут наиболее опасны из-за близости потенциала их выделения к потенциалу разряда ионов меди и способностью образовать перенасыщенные растворы, содержащие примеси в значительных количествах.
Из группы Ag, Au в электролит в незначительных количествах переходит Ag в виде сульфата, концентрация которого резко уменьшается за счет введения ионов хлора в виде NaCl или HCl. Общее содержание примеси может быть определена из соотношения:
A = (100*Cn/I)*(1/Kp + 1/Kд)
где:
Сn - концентрация примесей в растворе.
- константа скорости разряда примеси
- константа скорости конвективной диффузии.
С увеличением скорости циркуляции возрастает переход примеси в осадок. Содержание примеси уменьшается с уменьшением ее концентрации в электролите.
Накопление Ni в электролите осложняет процесс электролиза ввиду появления состояния пассивации анода, ухудшает физико-химические свойства электролита. Технические приемы снятия анодной пассивации:
- спец. обработка поверхности анода,
- подбор определенного состава электролита,
- повышение температуры электролита,
- использование нестационарных токов (реверс и импульс).
Основной технологической операцией по выводу никеля из электролита и поддержанию его стабильного состава является передача части раствора в купоросный цех с получением никельсодержащего продукта.
2.4 Теоретические основы цементации металлов
Цементация, или контактное вытеснение - одно из весьма распространенных в технической электрохимии явлений, при котором более электроположительный металл вытесняется из раствора своей соли металлом с более электроотрицательным потенциалом. Например:
Cu2+ + Fe = Cu + Fe2+
Из раствора простой соли (например, медного купороса) медь вытесняется металлическим железом. Цементация широко используется в гидрометаллургии для очистки электролитов от примесей, имеющих более положительные О/В-потенциалы по сравнению с осаждаемым целевым металлом. Метод надежен и не требует сложного аппаратурного оформления. В гальванотехнике явление цементации иногда может быть использовано для получения гальванических покрытий. Однако, как правило, оно нежелательно, так как цементационный слой осаждаемого металла имеет структуру рыхлого осадка, плохо связан с основой и ухудшает адгезию металла покрытия к основе.
Условием равновесия осаждаемого (М2) и цементирующего (М1) металлов является равенство их электрохимических потенциалов.
Учитывая, что потенциал цементирующего металла значительно сильнее сдвинут в сторону отрицательных значений по сравнению с потенциалом осаждаемого, приходим к выводу о возможности достижения весьма глубокой очистки раствора от ионов M z2+ с помощью такого простого метода. Однако термодинамические возможности цементации не всегда могут быть полностью реализованы в связи с существованием кинетических затруднений реакций растворения цементирующего металла и выделения осаждаемого из раствора.
В основе цементации лежит коррозионный процесс, иллюстрируемый обычно с помощью поляризационной диаграммы (рис. 2).
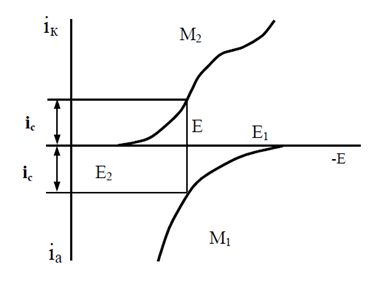
Рисунок 2 — Поляризационная диаграмма контактного обмена
Потенциал растворения цементирующего металла и осаждаемого из раствора устанавливается при плотности тока цементации ic. Из рис. 2 следует, что скорость процесса, выраженная в единицах плотности тока, определяется не только движущей силой процесса — разностью стационарных потенциалов в исходном растворе, но и характером кинетических затруднений как катодного, так и анодного процессов.
В связи с этим различают два вида контроля скорости цементации: активационный и смешанный. В зависимости от характера торможений электродных процессов по-разному изменяется и поверхность электрода: при подавляющем контроле стадии перехода в катодном процессе поверхность электрода можно рассматривать практически не зависящей от времени; преобладание диффузионного контроля приводит к образованию рыхлого цементационного осадка.
2.5 Теоретические основы кристаллизации металлов из водных растворов.
Во многих технологических процессах, связанных с обработкой твердых материалов в жидкой среде, приходится путем кристаллизации выделять в виде кристаллов растворенные в жидкости твердые вещества.
Кристаллизация представляет собой процесс выделения твердой фазы при затвердевании веществ, находящихся в жидком состоянии (из расплава), или процесс выделения твердого растворенного вещества из раствора.
Кристаллы представляют собой твердые химически однородные тела правильной формы. Строение кристаллов характеризуется симметричным расположением атомов, ионов и молекул в узлах пространственной решетки, которая образуется тремя взаимно пересекающимися системами плоскостей. В зависимости от условий образования кристаллов скорость роста их по отдельным граням может быть различной, вследствие чего кристаллы, сохраняя ту же самую кристаллическую решетку, принимают вытянутую или плоскую форму в зависимости от температуры и вязкости среды. Каждая из форм кристаллов остается устойчивой лишь в определенном интервале значений температуры и давления. При достижении предельных условий происходит переход одной кристаллической формы в другую, сопровождающийся тепловым эффектом; границы этого перехода определяются так же, как и при изменении агрегатного состояния вещества. Кроме того, каждая из кристаллических форм обладает отличной, свойственной только ей упругостью паров и растворимостью. В технологии многообразие форм кристаллов используют для получения одного и того же вещества в виде кристаллов определенной формы, обладающих различными свойствами, для чего создают соответствующие условия кристаллизации. Так, в зависимости от температуры кристаллизации некоторые вещества могут быть получены различного цвета. Например, йодная ртуть в зависимости от температуры может быть выделена в виде осадка, окрашенного в желтый или в красный цвет. Изменяют также свой цвет при различной температуре кристаллизации хромовые соли свинца. Форма и величина кристаллов оказывают существенное влияние на их дальнейшую обработку путем фильтрования, при котором оба эти фактора значительно влияют на скорость процесса. Известно, что чем крупнее кристаллы и отчетливее выражена их кристаллическая форма, тем эффективнее протекает процесс фильтрования.
Существенное влияние на кристаллизацию оказывает процесс гидратации, при котором выделяющиеся из раствора одна или несколько молекул растворенного вещества соединяются с одной или несколькими молекулами растворителя. При этом число присоединяющихся молекул растворителя может быть различным в зависимости от температуры и концентрации, при которых проводится кристаллизация.
Вследствие гидратации вещество из раствора выделяется в виде кристаллогидратов определенной формы, содержащих вполне определенное количество молекул растворителя (воды), причем содержание кристаллизационной воды в кристаллах сказывается не только на их форме, но и на свойствах.
Кристаллогидраты обладают определенной упругостью пара. Если упругость их пара больше упругости паров воды в окружающем воздухе при данной температуре, то кристаллы при хранении на воздухе теряют кристаллизационную воду - выветриваются. Наоборот, если упругость пара над кристаллогидратом меньше упругости паров воды в окружающем воздухе, кристалл «притягивает» из окружающего воздуха воду и постепенно «плавится». Для этих кристаллов при хранении на воздухе содержание кристаллизационной воды должно быть таким, чтобы не нарушалась форма кристаллов.
Все вещества, в том числе и твердые, обладают способностью в той или иной степени растворяться в различных жидких растворителях. Степень растворимости и концентрацию растворов чаще всего выражают в весовых процентах растворенного вещества по отношению к общему весу раствора или в граммах растворенного вещества на 100 г растворителя. Растворимость веществ зависит от их химической природы, свойств растворителя и температуры. Данные о растворимости различных веществ находят опытным путем и обычно изображают в виде кривых зависимости растворения от температуры. Растворимость многих веществ изображается плавной кривой, без излома, причем, как правило, с повышением температуры растворимость возрастает.
Для многих веществ, образующих кристаллогидраты, кривые растворимости имеют изломы; растворимость таких веществ может с повышением температуры уменьшаться.
Определение растворимости веществ при заданных температурах имеет большое практическое значение, но надежных расчетных формул нет, и в каждом конкретном случае приходится пользоваться опытными данными.
Раствор, который содержит максимально возможное для данной температуры количество растворенного вещества, называют насыщенным. Понижение температуры насыщенного раствора ведет к выделению из него части растворенного вещества; при этом количество растворенного вещества, остающегося в растворе, будет соответствовать состоянию его насыщения при температуре, до которой охлажден раствор. Наоборот, повышение температуры раствора в большинстве случаев дает возможность увеличивать концентрацию до тех пор, пока раствор снова не станет насыщенным. Зная зависимость растворимости вещества от температуры, можно проводить его кристаллизацию. Понижая температуру раствора путем охлаждения или удаляя из раствора часть растворителя путем испарения или выпаривания, нарушают фазовое равновесие, вследствие чего раствор пересыщается и часть растворенного вещества переходит в твердую фазу, образуя кристаллы определенной структуры.
На рисунке 3 приведена кривая растворимости в воде медного купороса в системе с серной кислотой.
Как уже отмечалось, для получения кристаллов должно быть сдвинуто фазовое равновесие, т. е. раствор должен быть пересыщен. При этом необходимо образование мельчайших кристаллических ядер-центров, из которых затем вырастают кристаллы определенной величины. Таким образом, весь процесс кристаллизации можно разделить на две стадии: образование ядер вследствие нарушения фазового равновесия раствора и рост образовавшихся ядер в растворе.
Механизм образования ядер-центров кристаллизации до сих пор теоретически недостаточно выяснен. Известно лишь, что если раствор твердого вещества, имеющего нормальную растворимость (возрастающую с повышением температуры), охлаждать до температуры ниже предела его насыщения, то начинается образование микроскопических ядер-центров, которое зависит от интенсивности охлаждения, скорости и способа перемешивания, температуры и свойств вещества, а также содержания примесей.
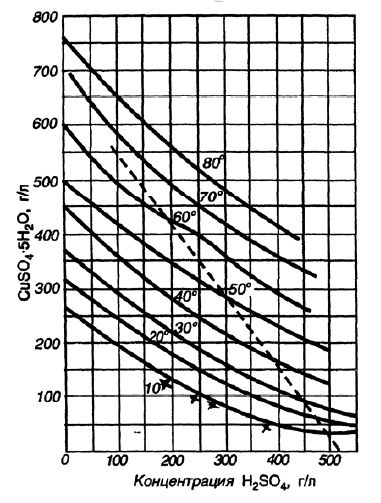
Рисунок 3 — Кривые растворимости медного купороса в системе с серной кислотой при различных температурах.
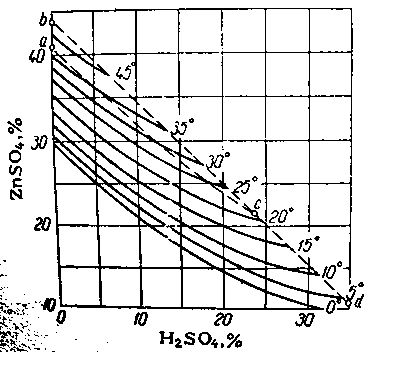
Рисунок 4 — Растворимость в системе ZnSO4 - H2SO4 - H2O. Твердые фазы: ниже acd - ZnSO4*7H2O; в области abc - ZnSO4*6H2O; выше bcd - ZnSO4*H2O
Практически установлено, что образованию большого количества ядер благоприятствуют быстрое охлаждение, энергичное перемешивание, высокая температура и небольшой молекулярный вес растворенного вещества. Количество возникающих при кристаллизации ядер непосредственно сказывается на форме и величине кристаллов. Появление только небольшого числа зародышей-ядер, способствует образованию крупных кристаллов. Медленный рост крупных кристаллов позволяет получать более полногранные формы кристаллов с хорошо развитыми плоскостями.
В случае, когда образуется значительное количество ядер-центров в единице объема раствора, получают мелкокристаллические осадки из микроскопических кристаллов со слабо развитыми гранями. В этом случае образуются преимущественно кристаллы пластинчатой или игольчатой формы. Кроме того, если большое число ядер возникает в сильно разведенных растворах, то твердая фаза получается столь тонко раздробленной, что ее трудно отличить от коллоидных осадков.
Многие растворы, как, например, растворы глауберовой соли, могут быть сильно пересыщены без выделения кристаллов. Выяснено, что для возбуждения процесса кристаллизации таких пересыщенных растворов необходимо ввести в раствор извне хотя бы один мелкий кристалл этой соли или какого-либо другого вещества с той же кристаллической структурой. Процесс кристаллизации протекает значительно легче вокруг имеющихся в растворе кристаллов или даже мельчайших кристаллических обломков того же вещества. Поэтому весьма часто при проведении процесса кристаллизации предварительно вводят в раствор некоторое количество кристаллов выделяемого вещества.
Развитие микроскопических ядер в видимые кристаллы начинается с того момента, когда возникли кристаллические центры-ядра, причем требуется постоянный приток твердого вещества к поверхности граней кристалла. В растворе, находящемся в состоянии покоя, по мере роста кристаллов жидкость, находящаяся в непосредственном соседстве с гранями кристалла, перестает быть пересыщенной, и если в эту зону не будет поступать материал из других соседних областей, то рост кристаллов прекратится. Перенос вещества, потребного для роста кристалла в неподвижной среде, происходит вследствие возникновения в растворе одновременно с ростом кристалла диффузионных и конвекционных токов.
Диффузионные токи возникают вследствие диффузии, т. е. процесса выравнивания концентраций раствора по всей его массе, протекающего во времени.
В основном все методы кристаллизации можно разбить на две группы:
1) кристаллизация с удалением части растворителя;
2) кристаллизация без удаления растворителя. Кристаллизация может проводиться периодически или непрерывно.
В некоторых случаях для осуществления кристаллизации требуется понизить растворимость кристаллизуемого продукта, что достигается введением в раствор какой-либо растворимой соли в сухом виде или в виде насыщенного раствора.
Если растворимость кристаллизуемого продукта с понижением температуры изменяется мало, то кристаллизацию чаще всего проводят путем удаления из раствора, некоторой части растворителя.
Удаление растворителя может быть осуществлено двояко: путем кипячения (выпаривания) или путем испарения при температурах, значительно более низких, чем температура кипения раствора.
Соответственно различают следующие виды кристаллизации с удалением части растворителя: 1) выпаривание с кристаллизацией, 2) кристаллизация с воздушным охлаждением, 3) вакуум-кристаллизация.
При выпаривании водных растворов в закрытых выпарных вакуум-аппаратах можно поддерживать низкие температуры и интенсивно удалять растворитель
Для получения крупных кристаллов нельзя превысить предел концентрации, достигаемый при выпаривании. Не всегда следует выпаривать растворы до насыщения, так как при сливании таких растворов в кристаллизатор процесс кристаллизации протекает слишком быстро, что ведет к образованию очень мелких кристаллов, а иногда весь раствор затвердевает. Поэтому в каждом конкретном случае необходимо знать предельную концентрацию, до которой можно выпаривать раствор, что устанавливают только опытным путем.
Удаление растворителя путем его испарения при атмосферном давлении протекает весьма медленно и кристаллизация длится значительное время, что создает условия для медленного роста кристаллов. Таким методом пользуются, в частности, при кристаллизации соли из морской воды или на соляных промыслах, где кристаллизацию проводят в больших бассейнах.
Но, как отмечалось выше, рост кристаллов зависит от того, как быстро происходит перемещение кристаллизуемого продукта из раствора непосредственно к граням кристаллических центров. Поэтому для ускорения кристаллизации необходимо либо искусственно уменьшить длину пути к центрам кристаллизации, либо создать путем перемешивания интенсивные токи жидкости.
В производственных условиях кристаллизацию с удалением части растворителя путем испарения его в окружающий воздух проводят в открытых прямоугольных ящиках-кристаллизаторах, в которых подвешиваются ленты или нити из химически стойкого материала.
Вследствие большой поверхности нитей (лент) на них осаждается основная масса чистых кристаллов; примеси осаждаются на дно и удаляются с маточным раствором.
Очистку нитей (лент) производят на специальных наклонных столах, где с кристаллов стекает маточный раствор. Для более полного удаления маточного раствора кристаллы центрифугируют, а затем сушат.
При расчете кристаллизаторов такого типа необходимо учитывать охлаждение раствора вследствие его испарения и отдачи тепла в окружающую среду через стенки аппарата. Количество жидкости, испаряющейся в единицу времени со свободной поверхности зеркала испарения, можно подсчитать по формуле самоиспарения.
Кристаллизация путем испарения растворителя без нагревания и перемешивания в большинстве случаев проводится исключительно для получения более крупных, отчетливо образованных кристаллов.
Крупные кристаллы не всегда являются более чистыми по сравнению с мелкими; часто крупные кристаллы срастаются в целые агрегаты, внутри которых содержится значительное количество маточного раствора и примесей.
Удаление растворителя путем испарения его при атмосферном давлении протекает медленно и требует громоздкой аппаратуры. Ускорение процесса кристаллизации достигается при перемешивании раствора в шнековых кристаллизаторах, которые могут работать периодически и непрерывно.
Охлаждение раствора в кристаллизаторе такой конструкции происходит только естественным путем вследствие испарения растворителя с открытой поверхности; несмотря на это, благодаря перемешиванию процесс кристаллизации в шнековых аппаратах протекает примерно в 6-7 раз быстрее, чем в кристаллизаторах ящичного типа.
К числу кристаллизаторов, непрерывно работающих с удалением части растворителя, относятся качающиеся и барабанные вращающиеся кристаллизаторы.
Более производительными, чем кристаллизаторы с естественным охлаждением и самоиспарением раствора, являются аппараты для кристаллизации, работающие под вакуумом.
Принцип вакуум-охлаждения заключается в том, что если раствор поместить в замкнутый аппарат и создать в последнем вакуум, то вследствие самоиспарения раствор охлаждается до температуры, соответствующей упругости пара над раствором.
Конденсацию выделяющегося пара производят, используя растворитель, в конденсаторах смешения или в поверхностных конденсаторах. Тепло конденсации передается растворителю, вследствие чего довольно значительно сокращается расход тепла.
В периодически действующих аппаратах вся жидкость удаляется при постоянном (максимальном) вакууме. В многоступенчатых вакуум-кристаллизационных установках часть жидкости (в первых ступенях) испаряется при меньшем вакууме, а максимальный вакуум достигается в последней ступени. Эти установки работают непрерывно и обладают значительной производительностью.
Кристаллизация без удаления растворителя. Хотя при кристаллизации с удалением растворителя кристаллы получаются крупными, зато, как было отмечено, создаются благоприятные условия для образования больших срастающихся агрегатов. В результате такого сращивания в кристаллизуемый продукт попадают примеси в виде маточного раствора. Кроме того, удаление растворителя методом испарения протекает весьма медленно, а выпаривание обходится сравнительно дорого. Поэтому очень часто кристаллизацию проводят, охлаждая раствор водой или холодильным рассолом в аппаратах, в которых осуществляется непрерывный ток раствора, или в аппаратах, снабженных механическими мешалками.
Кристаллизатор с перемешиванием и охлаждением представляет собой герметически закрытый цилиндрический котел с плоской крышкой и коническим дном; котел снабжен мешалкой. Охлаждение производится водой или холодильным рассолом, которые пропускаются через змеевик. Аппарат разгружают через штуцер, имеющийся в днище. Такие аппараты изготовляют также с рубашками, при этом, чтобы устранить выпадание кристаллов на стенках аппарата (что повело бы к значительному ухудшению теплопередачи), лопасти мешалки снабжают скребками или металлическими щетками.
Кристаллизаторы этого типа работают периодически или непрерывно. При непрерывной работе соединяют несколько аппаратов последовательно и раствор перетекает из одного кристаллизатора в другой.
Переработка медной стружки с получением товарных продуктов (ч.2) - Существующие технологии и выводы
Читайте также статьи
Техпроцесс меднения
Что такое медь? Механизм меднения. Основные электролиты и режимы процесса.
Оценка коррозионной стойкости меди
Оценка стойкости блестящего и матового медного покрытия на стали.
Заказать гальваническое меднение
Сделать заказ меднения с сертификатом качества на заводе

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



