

Меднение металла | Технология и механизм гальванического процесса | Структура и свойства меди в покрытии.
Содержание:
1. Что такое меднение? Назначение и обозначение медного покрытия.
2. Кинетика процесса гальванического меднения.
1. Что такое меднение? Назначение и обозначение медного покрытия.
Меднение — процесс нанесения тонкого слоя металлической меди на изделие для придания ему необходимых свойств.
Медные покрытия широко применяются в основном в качестве подслоя при нанесении многослойных покрытий, а также для улучшения пайки, создания электропроводных слоёв, уплотнения резьбовых соединений, местной защиты стальных деталей при цементации. В редких случаях используются для придания декоративного внешнего вида.
Медь — металл розового цвета с атомной массой 63,5, плотностью 8,9 г/см3, температурой плавления 1083°С, удельным электросопротивлением 0,017*Ом*мм. Медь пластична, твердость медных покрытий 2500-3000 МПа.
Медь интенсивно растворяется в аэрированных аммиачных и цианидных растворах, азотной кислоте, медленнее - в хромовой, слабо - в серной и почти не взаимодействует с соляной кислотой. На воздухе медь легко реагирует с влагой, углекислыми и сернистыми соединениями, окисляется и темнеет.
Стандартный потенциал меди по отношению к ее одновалентным нонам +0,52 В, двухвалентным ионам +0,34 В.
В жестких условиях эксплуатации медь и ее сплавы не должны контактировать с хромом, оловом, сталями, цинком, кадмием, алюминием и магнием.
|
Обозначение покрытия |
М - стандартное меднение, блеск не нормируется М. б - меднение блестящее М24 - искровзрывозащитное меднение (толщина не менее 24мкм) М. ч - меднение с декоративным чернением (состариванием/патинированием) galvanic copper plating - англ. обозначение |
|
Толщина |
6-100мкм (оптимально, но возможно осадить большую толщину) |
|
Микротвердость |
590-1470 МПа (60-150 кгс/мм2) |
|
Удельное электрическое сопротивление при 18°C |
1,68⋅10-8 Ом⋅м |
|
Допустимая рабочая температура |
300°C
|
2. Кинетика процесса гальванического меднения.
Для электролитического осаждения меди разработано большое количество электролитов, которые, обычно, разделяют на две группы: кислые и щелочные. Существуют как простейшие, так и достаточно сложные композиции для меднения.
Катодные поляризационные кривые для некоторых из них приведены на рисунке 1.
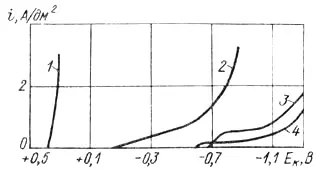
Рисунок 1 — Катодные поляризационные кривые при меднении из электролитов: 1 — сульфатный; 2 — пирофосфатный; 3 — цианидный ; 4 — цианидный с повышенным содержанием свободных цианидов.
2.1 Процессы в кислых электролитах меднения.
К кислым электролитам относятся сульфатные и фторборатные электролиты. Их основные достоинства - простота состава и устойчивость в эксплуатации, но они обладают низкой рассеивающей способностью. Также из них невозможно непосредственно меднить сталь из-за выпадения контактной меди, а, следовательно, плохое сцепление со сталью слоя меди. Вследствие этого меднение осуществляется после предварительного осаждения медного слоя (3-4 мкм) из щелочных электролитов или после осаждения никелевого слоя (3-5 мкм).
Из кислых электролитов наиболее распространен сульфатный электролит. Основными компонентами сульфатных электролитов являются сульфат меди и серная кислота. Электропроводность нейтральных растворов сульфата меди невелика, поэтому в них добавляют серную кислоту, которая значительно повышает электропроводность растворов температуры перемешивания.
Предполагается, что на катоде разряд двухвалентных ионов меди протекает в две стадии:
Cu2+ + e → Cu+
Cu+ + e → Cu
Замедленной стадией является первая реакция. Доля каждой стадии в общей кинетике меднения зависит от состава электролита и режима электролиза: плотности тока, температуры, перемешивания.
Выход меди по току около 100 %, так как выделения водорода на катоде не происходит, поскольку потенциалы выделения меди имеют более положительные значения, чем потенциалы выделения водорода.
Повышение кислотности электролита способствует уменьшению растворимости сульфата меди, что приводит к снижению верхнего предела допустимой плотности тока. Для увеличения концентрации ионов меди в катодном слое применяют перемешивание. В этом случае кислотность электролитов можно увеличивать. Чем интенсивнее перемешивание, тем выше может быть содержание серной кислоты. Повышение температуры способствует увеличению растворимости сульфата меди: при 25 °С — 23,05 г CuSO4 на 100 г воды; при 100 °С — 73,6 г. Повышенная кислотность способствует получению более мелкокристаллических осадков.
Вблизи анодов наряду с ионами Cu2+ в растворе могут находиться в незначительном количестве ионы одновалентной меди, образующиеся в результате протекания реакции:
Cu + Cu2+ ↔ 2Cu+
При накоплении в растворе ионов Cu+ равновесие будет сдвигаться влево, и металлическая медь будет выпадать в виде осадка.
При недостаточной кислотности раствора сульфат одновалентной меди будет гидролизоваться с образованием Сu(ОН)2 или СuО2
Cu2SO4 + H2O ↔ Cu2O + H2SO4
В результате в электролите будут взвешенные частицы металлической меди и оксида меди, которые, включаясь в катодный осадок, делают его темным, шероховатым, а иногда - рыхлым.
Присутствие серной кислоты способствует протеканию реакций окисления одновалентной меди:
Cu2SO4 + H2SO4 + 1/2О2 → 2CuSO4 + Н2О
Cu2O + 2H2SO4 + 1/2O2 → 2CuSO4 + 2H2O
Таким образом, серная кислота прежде всего нужна для предупреждения накопления ионов Cu+ и гидролиза ее солей.
В сульфатные электролиты меднения иногда вводят поверхностно-активные вещества. Эти вещества вводят для повышения катодной поляризации, что способствует получению более мелкозернистых плотных, иногда блестящих, осадков. Благоприятное действие этих добавок сказывается в том, что они предупреждают образование наростов на краях и выступающих частях деталей. Наилучшими добавками являются декстрин (не более 1 г/л) и фенол или его сульфосоединения (1-10 г/л).
Для получения блестящих медных покрытий предложено большое количество блескообразующих добавок, обеспечивающих зеркальный блеск покрытий, придающих им пластичность и снижающих внутренние напряжения.
При работе с электролитами для получения блестящих медных покрытий особое внимание следует уделять анодам. Анодный процесс растворения меди достаточно сложен и подробно описан в статье.
Взвешенные частицы шлама обычно являются причиной грубого шероховатого осадка. Вообще, медное покрытие особенно склонно к дендритообразованию при меднении с нарушением технологического процесса, к которому относится и присутствие шлама в растворе. Частички шлама становятся при этом центрами кристаллизации и ток, вместо того, чтобы идти на зарождение новых зерен меди, расходуется на обрастание и разрастание этих частиц. Дендриты могут появляться и по другим причинам, одной из которых также является превышение допустимой плотности тока на выступающих частях деталей. Примеры дендритов на медном покрытии приведены на рисунке 2. Пример дендрита на циллиндрическом катоде и поперечный рез такого дендрита приведены на рисунке 3.
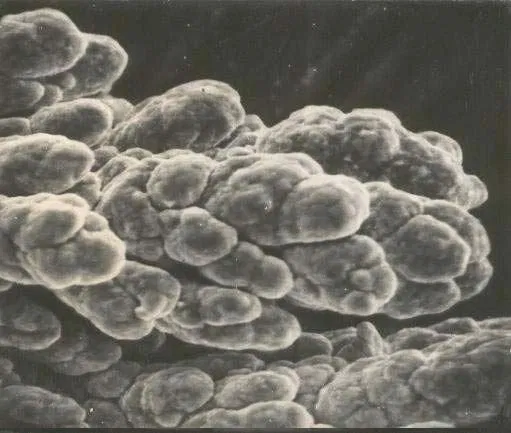
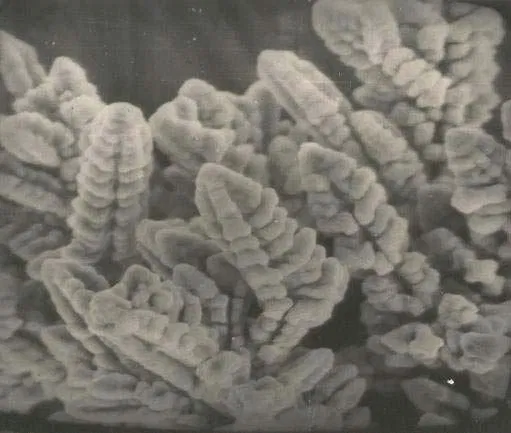
Рисунок 2 — Примеры дендритов на медном покрытии.


Рисунок 3 — Пример дендрита на циллиндрическом катоде и поперечный рез такого дендрита.
На качество получаемых блестящих покрытий большое влияние оказывает концентрация ионов Сl-. При пониженной концентрации снижается блеск покрытий и образуются прижоги на острых кромках деталей, при повышенном содержании образуются полосы на покрытиях.
Вредными примесями в медных сульфатных электролитах являются мышьяк, сурьма, некоторые органические вещества, образующие коллоидные растворы, анодный шлам.
Кроме сульфатных, используют фторборатные электролиты. Эти электролиты обладают высокой устойчивостью; получающиеся покрытия плотные и мелкокристаллические, рассеивающая способность электролитов примерно такая же, как у сульфатных. Большая растворимость фторбората меди позволяет применять повышенные плотности тока. Из этих электролитов меднить стальные детали напрямую нельзя; необходим подслой никеля или меди из цианидных электролитов.
2.2 Процессы в щелочных электролитах меднения.
К щелочным электролитам относятся цианидные, пирофосфатные и этилендиаминовые электролиты. Основные достоинства: высокая рассеивающая способность, получение мелкокристаллических осадков, возможность непосредственно меднить стальные детали.
2.2.1 Цианистое меднение.
Довольно распространены цианидные электролиты. Условия осаждения меди из цианидных электролитов существенно отличаются от условий осаждения в кислых электролитах.
В цианидных электролитах медь находится в составе комплексных ионов, степень диссоциации, а, следовательно, и активность ионов меди очень мала. Поэтому потенциал выделения меди в них примерно на 0,9-1,2 В отрицательнее, чем в сульфатных растворах.
При малом количестве цианида аноды пассивируются. При недостаточном количестве свободного цианида, когда происходит пассивация анодов и на них разряжаются ионы ОН- с выделением кислорода, то не весь образующийся кислород выделяется в виде газа, а часть его расходуется на окисление цианида в цианит. Уменьшение содержания цианидов происходит также из-за взаимодействия их с углекислотой воздуха и образования карбонатов (NaCN → Na2CO3 ).
Содержание свободного цианида оказывает на катодный и анодный процессы противоположное влияние: для катодного процесса требуется минимальное содержание цианидов, для анодного - максимальное. При недостатке свободного KCN на анодах образуется зеленоватая пленка CuCN из-за того, что ионы меди не в состоянии перейти в комплексное соединение. Свободная поверхность анода уменьшается, плотность тока растет, и анодное растворение происходит с образованием ионов двухвалентной меди, которые в виде нерастворимого гидрата осаждаются на аноде. При этом аноды пассивируются и наблюдается интенсивное выделение кислорода.
Основными компонентами медных цианидных электролитов являются комплексный цианид меди и свободный цианид натрия. Из приведенных данных видно, что степень диссоциации комплексных ионов очень мала и уменьшается с увеличением содержания CN- в комплексе. Этим, по-видимому, объясняется повышение катодной поляризации при увеличении содержания свободного цианида в электролите.
Содержание меди в электролите во время работы обычно уменьшается вследствие недостаточной растворимости анодов. Снижение концентрации ионов меди в электролитах приводит к образованию пористых осадков. Кроме того, работая с малоконцентрированными медными электролитами, можно применять только пониженные плотности тока.
Постоянным компонентом цианидных электролитов является карбонат. Он накапливается в результате окисления цианида кислородом воздуха, особенно при нагревании:
2NaCN + 2Н2О + 2NaOH + О2 = 2Na2CO3 + 2NH3
Присутствие карбонатов в небольших количествах полезно, поскольку при этом повышается электропроводность электролитов. Однако при их накоплении свыше 70 г/л, а в концентрированных - до 140 г/л аноды проявляют склонность к пассивированию, а покрытия получаются пористыми. Карбонаты можно удалять при помощи хлорида бария и вымораживанием, охлаждая электролит до -5 °С. Следует отметить, что карбонаты натрия легче выпадают в осадок, чем калиевые. Сульфаты существенного влияния на процесс электролиза не оказывают.
Введение в электролит депассиваторов, в качестве которых применяют сегнетову соль KNaC4H4O6•4H2O и роданид калия KCNS, позволяет повысить рабочую плотность тока и устранить пассивацию анодов, но при этом следует одновременно повышать температуру электролита.
Высококонцентрированные по меди электролиты, содержащие депассиваторы, позволяют применять высокие плотности тока (до 10 А/дм2) при повышенной температуре и перемешивании. При этом возможно получить выход по току, близкий к 100 %.
Сульфиды, вводимые в электролит, играют роль восстановителя, предупреждая накопление в ванне ионов меди Cu2+.
Для замены ядовитых цианидных электролитов применяют пирофосфатные и этилендиаминовые электролиты.
2.2.2 Пирофосфатное меднение.
Из пирофосфатных электролитов получают медные осадки с мелкозернистой структурой. При нанесении тонких слоев осадки получаются гладкими, блестящими или полублестящими. Преимущества пирофосфатных электролитов перед кислыми заключаются в высокой рассеивающей способности и возможности непосредственно проводить меднение стальных деталей в разбавленном пирофосфатном электролите.
Основные компоненты пирофосфатных электролитов меднения: CuSO4 или Сu2Р2О7 и К4Р2О7 или Na4P2O7. В растворах в присутствии Na4P2O7 образуется комплексная соль Na6[Cu(P2O7)2]; при избытке свободного пирофосфата может образовываться Na2[Cu(P2O7)2]. Константы нестойкости комплексов [Сu(Р2О7)2]6- и [Сu(Р2О7)2]2- соответственно равны 3•10-3 и 2•10-9.
В щелочных растворах при рН 8 и достаточном избытке свободных ионов Р2О74- медь находится преимущественно в виде шестизарядных комплексных ионов [Сu(Р2О7)2]6-.
В пирофосфатные электролиты вводят NH4NO3, который способствует повышению допустимой катодной и анодной плотностей тока и улучшает качество осадков. Из пирофосфатных электролитов можно получать блестящие осадки. В качестве блескообразующих добавок вводят Na2SeO3 совместно с лимонной или триоксиглутаровой кислотой, 2-меркаптотиазол и другие вещества.
При повышенных плотностях тока может происходить пассивация анодов за счет образования на их поверхности труднорастворимой оксидной или солевой пленки.
Катодный потенциал меди в пирофосфатных электролитах имеет более отрицательное значение, чем в кислых. Большая катодная поляризация объясняется пассивированием поверхности катода вследствие адсорбции ионов Р2О74- или образования оксидных (Сu2О8) и труднорастворимых соединений (Сu2Р2О7) в виде фазовой пленки.
Предполагают, что выделение меди на катоде из пирофосфатных растворов происходит в результате восстановления двухзарядных комплексов:
CuP2O72- + 2e- → Cu + Р2О74-,
образующихся при диссоциации шестизарядных комплексов:
Cu(P2O7)26- ↔ CuP2O72- + Р2О74-.
С повышением температуры ускоряется выделение меди, что связано как с ускорением диффузии комплексных анионов к катоду, так и с облегчением их разряда.
Структура осадков меди из пирофосфатного электролита более мелкая, по сравнению с сернокислымирастворами, с ростом плотности тока она укрупняется (рисунок 4)


Рисунок 4 — Микроизображения покрытия после меднения из пирофосфатного электролита при плотности тока 0,5 А/дм2 (слева) и 1 А/дм2 (справа).
Анодный выход по току в этих электролитах несколько выше катодного, поэтому при корректировке нет необходимости добавлять медные соли. Анодную плотность тока рекомендуется поддерживать в пределах 2-4 А/дм2. При более низкой плотности тока растворение идет недостаточно быстро, при более высокой - на поверхности анодов образуется труднорастворимая оксидная пленка.
Для предотвращения пассивации анодов должно быть достаточное количество свободных анионов Р2О74- и достаточно высокое рН раствора. Повышение температуры способствует отводу продуктов реакции и, следовательно, уменьшению пассивации анодов. Для этой же цели в электролиты вводят депассиваторы, которые способствуют снижению активности ионов Cu2+ в прианодном слое.
При работе пирофосфатных ванн рекомендуется проводить фильтрацию электролита: для полублестящих осадков - периодически или непрерывно, для блестящих - непрерывно.
Особенностью этилендиаминовых электролитов меднения является возможность непосредственного меднения стальных деталей. Детали в ванну загружают под током плотностью в 3-5 раз превышающей рабочую.
Анодные процесы при меднении так же рассмотрены здесь
Читайте также статьи
Заказать гальваническое меднение (М.б)
Сделать заказ меднения с сертификатом качества на заводе
Оценка коррозионной стойкости меди
Оценка стойкости блестящего и матового медного покрытия на стали.
Декоративное меднение с чернением (состариванием)
Декоративное покрытие, придающее изделию антикварный внешний вид.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



