

Серебряные аноды для гальваники
Гальваническое серебрение активно применяется в электротехнике, а также как теплопроводящее, светоотражающее и защитно-декоративное покрытие.
ГОСТ 25474-2015 Аноды серебряные. Технические условия.
Серебряные аноды выпускаются только одной марки:
|
Марка |
Ag, % |
Максимальное содержание примесей, % |
|||||||
|
Cu |
Pb |
Fe |
Sb |
Bi |
Te |
Pd |
Mn |
||
|
Ср 99,99 Ан |
99,998 |
0,008 |
0,001 |
0,002 |
0,001 |
0,0005 |
0,002 |
0,001 |
0,001 |
1. Общие сведения о серебрении.
Серебро представляет собой пластичный металл, который обладает высокой электро- и теплопроводностью, исключительной отражательной способностью, коррозионной стойкостью во многих средах, бактерицидными свойствами. В связи с этим серебро и покрытия на его основе широко применяется в приборостроении, радиотехнике, электронике и медицине. Кроме того, декоративные свойства серебра (особенно после чернения или тонирования) находятся на высшем уровне, что делает его востребованным в художественной и ювелирной промышленности.
Гальваническое серебрение позволяет производить серебряные покрытия серийно, при этом не опуская планку качества. Постоянно разрабатываются новые составы электролитов и совершенствуются старые, чтобы соответствовать всё возрастающим запросам производства.
Один и тот же металл в гальванике обычно может быть осажден как из простых, так и из комплексных электролитов. Серебро же, в связи с тем, что в растворах простых солей оно замещается менее благородными металлами, наносится только из растворов комплексных солей.
Среди электролитов серебрения самое широкое распространение получили цианистые. Впервые их применили в 1840 году, и с тех пор их состав не менялся. Но в XX веке человечество задумалось о своем здоровье и благополучии планеты, и решило заменить токсичные цианистые электролиты на менее вредные, не содержащие свободных цианидов CN-. Так появились железистосинеродистый, пирофосфатный, роданистый, йодистый, децианоаргентатный, сульфаматный и многие другие бесцианистые электролиты серебрения.
Общим для этих составов, как и для всех гальванических ванн в целом, является тот факт, что для стабильного процесса электроосаждения очень важна нормальная работа анодов. Особенно это касается растворимых анодов (в случае серебрения, разумеется, серебряных).
2. Цианистые электролиты и механизм анодного процесса в них.
Цианистый электролит известен еще с XIX века. В его состав входят комплексная серебряная соль K[Ag(CN)2] и свободный цианид калия KCN. Также в электролит вводят поташ K2CO3 либо кальцинированную соду Na2CO3, что повышает устойчивость цианидного комплекса серебра и повышает электропроводность раствора.
Несмотря на высокую токсичность этого электролита, он до сих пор остается самым популярным. Цианистый электролит не сдает позиций, т.к. в нем наблюдается наибольшая катодная поляризация и обеспечивается осаждение равномерного мелкокристаллического покрытия на деталях любой сложности. Выход по току серебра из этого электролита достигает 100 %. Все это связано, во многом, с очень низкой константой нестойкости K[Ag(CN)2], равной 10-22.
Процесс серебрения из цианидной ванны ведется с растворимыми серебряными анодами марки Ср99,99. Анодный процесс, заключающийся в ионизации серебра, протекает без особых затруднений. Наиболее сильное влияние на характер анодных поляризационных кривых оказывает концентрация серебра, KCN и K2CO3.
Пассивация поверхности анода начинается при потенциале >+0,2В, и чем выше анодная плотность тока, тем сильнее пассивация, вплоть до начала процесса перепассивации, когда на аноде начинают идти сторонние реакции. В начале пассивации анод покрывается коричневой пленкой, которая в большей мере состоит из Ag2O. При росте потенциала до +0,6В образуется уже более плотная пленка из AgO. С ростом потенциала до +0,8В и дальше на аноде образуется Ag2O3 и он становится практически нерастворимым. Можно заключить, что начиная с потенциала +0,3В, анодный процесс может стать сдерживающим фактором производительности ванны.
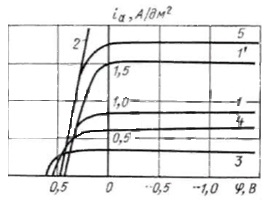
Рисунок 1 - Анодные поляризационные кривые в цианистом электролите с разными концентрациями компонентов:
|
№ электролита |
Содержание, г/л |
|
|
K[Ag(CN)2] |
KCN |
|
|
1 |
10 |
50 |
|
2 |
65 |
|
|
3 |
10 |
10 |
|
4 |
- |
|
|
5 |
65 |
50 |
Для анодов в цианистых ваннах есть некоторая особенность: их рекомендуется отжигать при 500-600 °С перед загрузкой в электролит - после отжига аноды растворяются более равномерно.
Применение ультразвука положительно влияет на анодный процесс. Повышается допустимая анодная плотность тока, поскольку под действием ультразвука пассивная пленка на аноде разрушается.
3. Бесцианидные электролиты серебрения и механизм анодного процесса в них.
Как известно, цианистые электролиты, несмотря на все их плюсы, являются очень ядовитыми. Токсичные сами по себе KCN или NaCN в кислой среде легко превращаются в не менее вредную синильную кислоту. Попадание цианида натрия или калия в организм человека провоцирует появление экземы, комплексы цианид-ионов с Fe2+ становятся преградой для переноса кислорода кровью, что вызывает сильнейшее кислородное голодание. Попадание в организм более 50 мг цианидов или синильной кислоты чревато летальным исходом. Все эти устрашающие факты наталкивают на мысль о замене цианистых электролитов на бесцианистые.
3.1 Железистосинеродистый (гексацианоферратный) электролит.
Одним из бесцианидных электролитов серебрения является железистосинеродистый электролит, который давно применяется в гальванотехнике.
При кипячении AgCl с железистосинеродистым калием протекает следующая реакция:
4AgCl + 2K4[Fe(CN)6] + 2Na2CO3 + 3H2O + 1/2O2 = 4K2[Ag(CN)3] + 4NaCl + 2Fe(OH)3 + 2CO2
Предельное значение плотности тока, при котором серебряные аноды исправно работают в данном электролите составляет 0,2 А/дм2. Уже при таких низких значениях начинается сильная пассивация анодов и выделение ядовитого газа - дициана C2N2. Поэтому вместо растворимых анодов используют нерастворимые либо их комбинацию. Работа с нерастворимыми анодами имеет свои тонкости - электролит в этом случае нуждается в постоянной корректировке. С растворимыми анодами процессы нормального растворения серебра в железистосинеродистом электролите протекают следующим образом:
Ag → Ag+ + e
Ag+ + CN- = AgCN
AgCN + CN- = Ag(CN)2-
При недостатке цианид-ионов реакция примет следующий вид:
Ag → Ag+ + e
Ag+ + CN- = AgCN
На рисунке 2 приведены анодные поляризационные кривые для процесса растворения серебра в железистосинеродистом электролите.
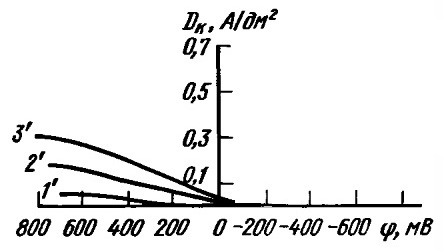
Рисунок 2 - Анодные поляризационные кривые для процесса растворения серебра в железистосинеродистом электролите при 20° С (г/л): 1 - 15 Ag (в пересчете на металл), 40 K4Fe(CN)6, 40 K2CO3; 2 - 15 Ag (в пересчете на металл), 200 K4Fe(CN)6; 3 - 15 Ag (в пересчете на металл), 200 K4Fe(CN)6, 2 Трилон Б.
Исходя из вышеизложенного можно заключить, что растворение анодов протекает без затруднений на малых плотностях тока. Далее скорость диффузии CN- из объема электролита становится недостаточной и начинается пассивация анодов с образованием плёнки AgCN.
Некоторым изменением состава электролита можно улучшить стойкость анодов к пассивации. Например, было предложено вводить избыток K4[Fe(CN)6]. При этом плёнка на аноде приобретает рыхлую структуру, соответственно, анод полностью не пассивируется. Введение в электролит небольшого количества Трилона Б также тормозит пассивацию.
Установлено, что применение карбоната калия K2CO3 вместо карбоната натрия Na2CO3 делает растворение анодов более легким, но, в то же время, чрезмерное накопление карбонат-анионов в растворе вызывает утолщение и уплотнение пассивирующего слоя на аноде.
Вторым вариантом борьбы с пассивацией серебряных анодов в железистосинеродистом электролите может быть повышение температуры электролита до 60 °С. В таких условиях образующаяся на аноде плёнка становится хорошо растворимой.
Анодную пассивацию можно предотвратить и механическим путем, а именно - покачиванием анодов в гальванической ванне. Экспериментально было установлено, что движение анодов способствует их хорошему растворению даже на плотностях тока в 3-5 А/дм2.
Форма тока также влияет на пассивируемость анодов. Периодическое изменение направления тока, а также наложение переменного тока на постоянный значительно снижают вероятность образования плёнки на поверхности анода.
3.2 Синеродистороданистый электролит.
Синеродистороданистый электролит обладает свойствами, близкими к цианистому электролиту, так как серебро разряжается из цианистого комплекса. Выход по току серебра из такого электролита близок к 100%, а рассеивающая способность даже выше, чем у цианистого. В то же время он имеет несколько недостатков - сложность приготовления и потери серебра на гидроксиде железа Fe(OH)3, мелкодисперсный порошок которого на одной из стадий приготовления электролита захватывает около 20% серебра.
Для приготовления данного электролита смешивают: хлорид серебра AgCl, гексацианоферрат (II) калия K4[Fe(CN)6], карбонат натрия Na2CO3 и роданид калия KCNS.
Растворение серебряного анода происходит с образованием роданистого комплекса:
Ag + 2CNS- - e → [Ag(CNS)2]-
А при его миграции к катоду происходит обмен:
[Ag(CNS)2]- + 2CN- → [Ag(CN)2]- + 2 CNS-
KCNS играет роль промежуточного комплексообразователя, не позволяя ионам Ag+ скапливаться у анода, поэтому пассивация не наступает.
Без добавки роданистого калия анодный выход серебра по току нулевой. При добавлении KCNS даже в количестве 50 г/л возможна работа с выходом по току 100 %. При данной концентрации предельный ток наступления анодной пассивации составляет около 0,5 А/дм2, при добавлении больших количеств он резко возрастает в несколько раз.
Увеличение концентрации серебра оказывает положительное влияние на анодный процесс, уменьшая поляризацию анода.
3.3 Дицианоаргентатный электролит.
Дицианоаргентатнороданистый электролит прост в приготовлении и обладает отличными эксплуатационными характеристиками. Покрытия, полученные из этого электролита не отличаются от покрытий из цианистого - они также мелкокристалличны и износостойки.
Дицианоаргентатный электролит в основном состоит из дицианоаргентата калия K[Ag(CN)2] и роданида калия KCNS.
Осаждение серебра на катоде происходит из комплекса [Ag(CN)2(CNS)]2-, либо из комплекса [Ag(CN)2(CNS)]3-. Первый разряжается при низкой концентрации роданида, второй же - при высокой. Растворение анодов происходит в виде роданистого комплекса K[Ag(CNS)2] благодаря роданиду калия KCNS в составе.
Рассмотрим роль роданида в растворении серебряных анодов более подробно.
Анодный процесс в зависимости от добавки KCNS демонстрирует поляризационные кривые на рисунке 3.
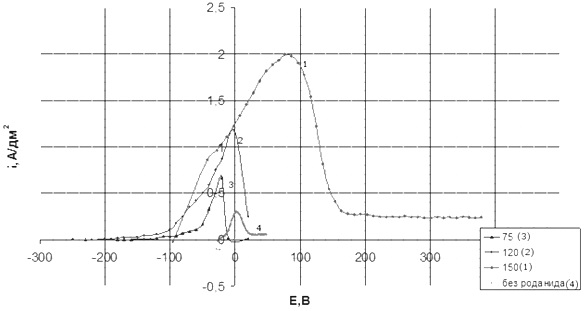
Рисунок 3 - Анодные поляризационные кривые в дицианоаргентатном электролите в зависимости от концентрации роданида калия.
По кривой № 4 можно отметить, что в отсутствие роданида калия ток пассивации минимален и составляет 0,3 А/дм2. Растворения анодов не происходит, поскольку свободных цианид-ионов CN- слишком мало, а CNS--ионы, ответственные за анодное растворение, отсутствуют. При введении роданида калия в количестве 75 г/л ток пассивации удваивается. Этот факт подтверждает, что анодное серебро растворяется с образованием комплекса роданида. С дальнейшим увеличением концентрации KCNS ток пассивации растет практически пропорционально, а потенциал сдвигается в положительную область. Бестоковый потенциал при росте концентрации KCNS смещается в более отрицательную область, значит, ионизация серебра осуществляется легче.
Если рассматривать анодный выход серебра по току, то он соответствует зависимостям поляризационной кривой (таблица 1). Информации об анодном выходе по току в отсутствие роданидов нет, поскольку сразу наступала пассивация анодов. При концентрации 75 г/л аноды стабильно растворяются до плотности тока 0,5 А/дм2, при концентрации 120 г/л - до 0,7 А/дм2, при концентрации 150 г/л - до 1 А/дм2.
|
Концентрация роданида калия, г/л |
Анодный выход по току, % |
||
|
При j = 0,4 А/дм2 |
При j = 0,5 А/дм2 |
При j = 0,7 А/дм2 |
|
|
75 |
80 |
82 |
20 |
|
120 |
- |
80 |
50 |
|
150 |
68 |
68 |
66 |
3.4 Пирофосфатный электролит.
В своем составе пирофосфатный электролит имеет: нитрат серебра AgNO3, калий пирофосфорнокислый К4Р2О7, карбонат аммония (NH4)2CO3. Также вводят NH4OH для лучшего растворения комплекса K7[Ag(P2O7)2], который образуется в результате реакции пирофосфата калия с нитратом серебра:
AgNO3 + 2K4P2O7 → K7[Ag(P2O7)2] + KNO3
Опционально добавляют KCNS для получения смешанного электролита.
Данный электролит не получил широкого распространения ввиду многих недостатков. Невысокая рассеивающая способность позволяет использовать его только для покрытия простых по конструкции деталей. Один из главных компонентов электролита К4Р2О7 - достаточно дорогой и редкий реактив, что делает пирофосфатный электролит на порядок дороже, например, цианидного. В то же время пирофосфатная ванна серебрения очень стабильна во времени и работает при комнатных температурах.
Анодный процесс в данном электролите в основном зависит от двух факторов: концентрации пирофосфата калия и концентрации водного раствора аммиака.
С повышением концентрации пирофосфата калия от 50 до 500 г/л анодный ток пассивации удваивается - с 0,5 до 1 А/дм2.
Добавление аммиака и увеличение его концентрации в электролите облегчает процесс растворения анодов. Так, рост концентрации аммиака от 0 до 40 г/л приводит смещению предельного тока пассивации с 0,8 до 1,6 А/дм2. При этом резко уменьшается поляризация анода, что говорит об ускорении анодного процесса и ионизации серебра в виде аммиакатных комплексов [Ag(NH3)2]+, которые в глубине раствора переходят в смешанные пирофосфатные. Для стабильной работы анодов в пирофосфатном электролите необходимо, чтобы анодная плотность тока не превышала 0,6-0,7 А/дм2.
Другие факторы на процесс растворения анодов влияния не оказывают.
3.5 Йодистый электролит.
Электролит готовится путем растворения хлорида, сульфата или нитрата серебра в концентрированном растворе иодида калия KI. В электролите серебро находится в виде комплексной соли K2AgI3:
AgCl + 3KI = K2AgI3 + KCl
Такой простой состав - одно из преимуществ йодистого электролита. Покрытия из него получаются мелкокристалличными, анодный и катодный выходы по току равны 100%, рассеивающая способность достаточно высокая и позволяет осаждать покрытия на детали сложной конструкции.
Недостаток йодистого электролита - это крайне высокая цена KI. Помимо этого, электролит неустойчив в эксплуатации из-за окисления K2AgI3 на аноде. Также к недостаткам относится желтоватый оттенок покрытия, хотя это и не влияет на физико-химические свойства покрытия - только на эстетические.
Рассматривая анодные процессы, можно отметить, что возможно образование пассивной пленки AgI по реакции:
Ag+ + AgI2- → 2AgI
Но при наличии большого избытка KI пассивация нарушается и пленка иодида серебра на аноде начинает растворяться:
AgI + KI → KAgI2
Исследование йодистого электролита показало, что при росте концентрации KI от 250 г/л до 500 г/л предельный ток наступления пассивации анодов повышается в разы. Кроме этого, избыток KI обеспечивает устойчивость комплекса серебра, поскольку его диссоциация уменьшается и возможность образования AgI сдвигается в сторону больших плотностей тока. Однако, при повышенных плотностях тока анодный процесс резко затормаживается из-за диффузионных ограничений.
Другие факторы, помимо концентрации иодистого калия, на анодные процессы влияния не оказывают.
Читайте также статьи
Техпроцесс гальванического серебрения
Описание процесса осаждения гальванического серебра. Свойства покрытия.
Заказать гальваническое серебрение (Ср)
Сделать заказ серебрения с сертификатом качества на заводе.
Альтернатива покрытию серебром
Замена серебряного покрытия высокооловянистым сплавом медь-олово (белой бронзой)

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



