
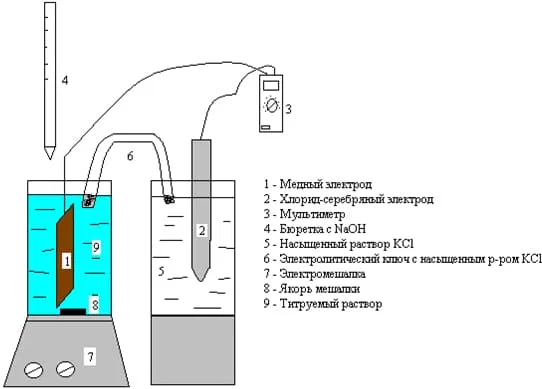
Потенциометрическое титрование
Потенциометрическое титрование основано на том же законе эквивалентов, что и объемное титрование. Но определение точки эквивалентности происходит не визуально по смене цвета раствора, а инструментально, благодаря чему метод относят к физико-химическим. Основная идея потенциометрии заключается в том, что точка эквивалентности связана со скачком потенциала электрода, обратимого относительно ионов титруемого вещества. Такой электрод называется индикаторным электродом. Скачок связан с заменой потенциалопределяющих ионов при титровании, когда добавлена лишняя капля титранта, все исходные потенциалопределяющие ионы оттитрованы и потенциал определяется лишь ионами титранта. Схема установки представлена ниже.

Метод потенциометрии имеет некоторые особенности, на которые всегда следует обращать внимание. Например, под каждую систему подбирается свой измерительный электрод. Возникает необходимость обязательного использования магнитной мешалки, причем ее якорь не должен касаться стенок стакана и поверхности электрода, обеспечивая достаточную скорость перемешивания. Нельзя допускать, чтобы титрант попадал непосредственно на электрод. В электролитическом ключе должен отсутствовать воздух (пузырьки). Показания мультиметра следует снимать только после установления равновесия (когда показания не изменяются во времени).
По результатам титрования строятся кривые 1 и 2:
Е = f (V) и ΔE/ΔV = f (V)
где:
Е — показания мультиметра (потенциал)
V — объем добавленного титраната
ΔE — приращение потенциала
ΔV —приращение объема титранта
Первая кривая называется интегральной, вторая — дифференциальной. Примеры кривых приведены на рисунке ниже. Точку эквивалентности можно определить по любой из этих кривых, но вторая кривая позволяет сделать это более точно.
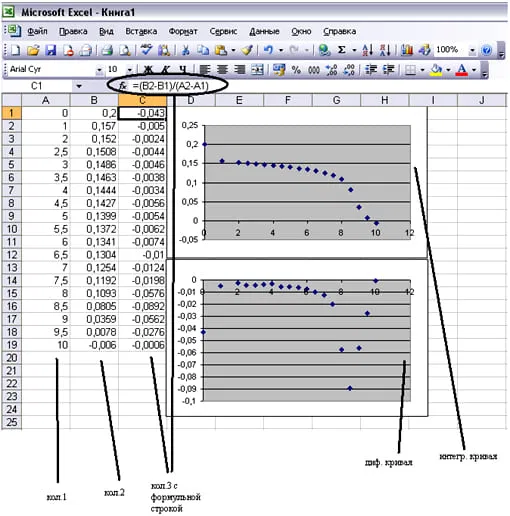
По положению пика на дифференциальной кривой определяется объем титранта, пошедший на титрование. Приращения потенциала и объема находятся как E2 – E1 и V2 –V1, где индекс 2 соответствует последующему значению, а индекс 1 – предыдущему. Скачков потенциала и соответственно пиков на графике может быть несколько. В случае, например, титрования смеси кислоты и сульфата меди в электролите матового меднения первый пик будет соответствовать кислоте, а второй – меди. Объем титранта берется как промежуток от первого пика до второго на оси абсцисс. Расчет анализа удобнее вести на компьютере.
Потенциометрическое титрование с помощью рН-метра.
Разновидностью метода потенциометрии является рН-метрия. Суть метода заключается в измерении рН раствора после каждого добавления порции титранта с помощью рН-метра. По данным анализа строятся аналогичные первому варианту таблицы и графики. Преимуществом данного метода является отсутствие хлоридсеребрянного электрода и электролитического ключа, что экономит рабочее пространство и делает анализ максимально быстрым. Вместо рН-электрода может быть использован иной подходящий ионселективный электрод.
Основное преимущество потенциометрических методов перед объемным титрованием – возможность использования при анализе мутных и окрашенных растворов. Кроме этого, они позволяют объективно оценить точку эквивалентности без привязки к цветовосприятию человека - исполнителя анализа.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



