
Механизм и кинетика электрохимического полирования
1. Общие сведения о процессе электрополировки.
Электрохимическое полирование – это обработка детали-анода в специальном электролите под током достаточно высокой плотности. Электрохимполировка существует наряду с традиционной механической и бестоковой химической. Наибольшее распространение получил процесс электрохимполирования таких материалов, механическое полирование которых затруднительно: медные, алюминиевые сплавы и коррозионно-стойкая сталь. Так, аустенитные хромоникелевые стали типа AISI 304 и хром–никель–молибденовые типа AISI 316 широко используются в тяжелой, пищевой, космической промышленности, авиа- и автомобилестроении, ювелирном деле, а также в медицине. При изготовлении деталей из нержавеющей стали зачастую возникают вопросы улучшения чистоты поверхности, увеличения коррозионной стойкости и блеска. Одним из вариантов решения проблемы как раз таки и является электрохимическая полировка.
Первый патент на электролитическую полировку был опубликован Шпитальским в 1910 году. Шпитальский который работал над полировкой серебра в растворах цианида. В промышленном масштабе электрополирование впервые было применено после Второй мировой войны для обработки углеродистых и легированных сталей. Наилучшие технико-экономические результаты были получены для нержавеющих сталей, механическая полировка которых не приводила к таким же результатам, как электрополировка.
Особое место сегодня электрополировка занимает при изготовлении хирургических инструментов и имплантатов. Например, исследования, проведенные Наврат, привели к внедрению электрополировки и химической пассивации имплантатов, изготовленных из стали AISI 316L (винты, пластины и компрессионно-дистракционные устройства) на заводе “Микромед”. В соответствии со стандартом PN-EN ISO 14630 имплантаты, изготовленные из стали AISI 316L после процесса электрохимической полировки, характеризовались средним коэффициентом шероховатости Ra < 0,16 мкм и очень хорошей коррозионной стойкостью. Также электрополировка часто применяется при изготовлении зубных коронок.
Эффект электрополировки поверхности металлических деталей заключается в следующем:
- Макрополировка, т.е. удаление пиков высотой до 100 мкм, что приводит к сглаживанию поверхности;
- Микрополировка, т.е. удаление выступов высотой приблизительно 10 мкм, что придает поверхности глянцевый вид благодаря высокоупорядоченному однонаправленному отражению лучей света;
- Пассивация с образованием тонкого оксидного слоя на поверхности.
К основным преимуществам электрополировки относится следующее:
- Небольшая, по сравнению с механообработкой, трудоемкость, высокая производительность и автоматизируемость, возможность полировать участки недоступные для механического инструмента, тонкие, ажурные изделия;
- Возможность получать поверхность, микрорельеф которой значительно больше сглажен, чем при механическом шлифовании и полировании (рисунок 1).

Рисунок 1 - - Профилограммы поверхности стальных образцов, обработанных шлифованием (а); механическим полированием (б); электрохимическим полированием (в).
- Поверхностный слой обрабатываемых деталей не претерпевает грубых структурных изменений. Выявляется кристаллическая структура поверхности, пассивация идет равномерно, что защищает изделие от коррозии и потускнения. Улучшение антикоррозийных свойств изделий из, например, нержавеющей стали происходит за счет создания пассивного слоя, содержащего оксид хрома Cr2O3, оксид никеля NiO, оксид молибдена Mo2O3 и оксид железа Fe2O3. Существует только один случай, когда в процессе электрополировки на поверхности анода вообще не образуется оксидный слой – обработка серебра в растворах цианидов. В этом случае создается солевая пленка, которая полностью совпадает по смыслу с оксидной пленкой при иных видах электрополировки.
- Покрытия, получаемые на полированных электрохимическим способом образцах, более мелкокристаллические и малопористые, лучше сцепленные с основой. Перед их нанесением не требуется обезжиривание. Электрохимическое полирование деталей после нанесения покрытий (например никеля и серебра) повышает их коррозионную стойкость.
- Снижается коэффициент трения, а также облегчается скольжение материалов, соприкасающихся с полированной поверхностью.
- Электрополированные детали легче моются, адгезия бактерий к ним уменьшается. Это важное требование в фармацевтической и пищевой промышленности.
- Устраняются микронапряжения в поверхностном слое, вызванные предшествующей обработкой, восстанавливается равномерная микротвердость исходного материала. Малоцикловая усталость образцов, отполированных электрохимическим способом на 87% выше, чем у образцов, отполированных механически.
- Такой полировкой деталям придаются специальные оптические свойства.
Электрохимическим полированием также готовятся образцы для исследований, например, шлифы в металлографии и фольга в электронной микроскопии.
Недостатками процесса электрохимполировки являются:
- В качестве электролитов используются смеси концентрированных кислот, что накладывает определенные эксплуатационные ограничения на процесс и организацию безопасного труда.
- Растворы необходимо регулярно контролировать по составу и регенерировать.
- Необходимость в частой смене электролитов, что также сопряжено с получением большого количества химических отходов;
- Отсутствие универсального электролита для различных металлов;
- Необходимость предварительной механической подготовки для удаления крупных царапин, забоин, раковин,
- Повышенный расход электроэнергии.
Однако не все типы металлов могут быть отполированы одинаково хорошо - необходима исходно однородная и мелкозернистая структура поверхности, без неметаллических включений. Степень сглаживания тем выше, чем однороднее структура металла. При выполнении этих условий результат процесса электрохимического полирования во многом зависит от пяти главных параметров:
- тип, форма, плотности тока,
- температуры,
- состава раствора,
- режима перемешивания электролита,
- времени проведения процесса.
2. Механизм процесса электрохимического полирования.
Металлы и их сплавы при погружении в специальный электролит в соответствующих условиях электролиза растворяются:
Анод: M0 - ze- → Mz+
Катод: 2H+ + 2e- → H2
Очевидно, что полирование будет осуществляться только в том случае, если микровыступы будут растворяться быстрее, чем металл в микровпадинах.
Переход в раствор ионов металла при анодном растворении не всегда идет в виде простых соединений, часто - в виде сложных гидратированных ионов:
Me + xH2O – ze- → Mez+·xH2O
Me + xH2O + yA- - ze- → [MeAy]z-y·xH2O
Например, полировка легированных сталей в фосфатно-сульфатных электролитах связана с появлением ионов [Fe(PO4)3]6-, [Fe(HPO4)3]3-, и если ванна содержит щавелевую кислоту, то [Fe(C2O4)3]3-.
Электролиты полировки могут быть как водными, так и безводными.
Существует множество (иногда противоречивых) представлений о механизме электрохимического полирования в целом и о его отдельных процессах:
Первое описание представлено Жаке в 1930-х годах. Согласно Жаке фактор, который оказывает наибольшее влияние на сглаживание поверхности при электрополировке, заключается в появлении на аноде высоковязкого неравномерного по толщине слоя (рисунок 2).
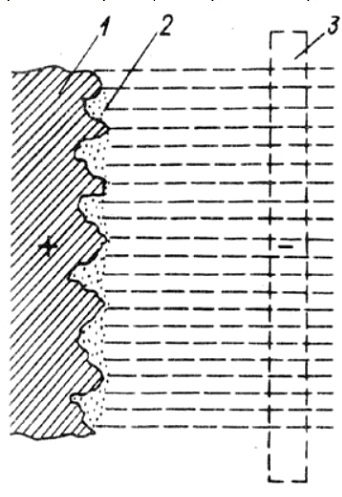
Рисунок 2 - Смеха расположения пленки на поверхности анода: 1 - анод; 2 - анодная пленка; 3 - катод
Анодный диффузионный слой является плоским на стороне, обращенной к раствору и катоду, в то время как на стороне, прилегающей к аноду, он принимает форму анодной поверхности. Этот слой характеризуется высоким электрическим сопротивлением. Однако на микровыступах этот слой тоньше, чем на микровпадинах. В результате пики шероховатости растворяются первыми, поскольку через них проходит ток более высокой плотности, идя по пути наименьшего сопротивления. В целом процесс электрополировки протекает в условиях предельного тока. Сильная адгезия вязкого слоя к поверхности способствует стабильности описанных условий вблизи поверхности анода.
Согласно другой гипотезе, также основанной на наличии высоковязкого слоя, важную роль в процессе играют так называемые акцепторы растворения металла. Акцепторами анодного процесса могут быть, например, частицы воды и анионы, которые присутствуют в ванне. Вода вызывает гидратацию ионов металлов, позволяя им отделяться от поверхности, поэтому диффузия акцепторов к поверхности имеет решающее значение при анодном растворении. Во время электрополировки концентрация акцепторов вблизи анода низкая, градиент их концентрации увеличивается на микровыступах, поэтому они подвергаются растворению в первую очередь.
Датт и Ландольт также объяснили механизм процесса электрохимической полировки появлением на поверхности анода слоя высокой плотности и вязкости, с низким содержанием воды и высокой концентрацией продуктов растворения металла и компонентов ванны. Он непрерывно разлагается и перестраивается заново. По мнению авторов через пленку активно идут процессы диффузии и миграции ионов в отсутствии конвекции. Гипотетически можно предположить, что в случае отсутствия концентрационного и температурного градиента в идеально перемешиваемой ванне происходил бы только миграционный перенос ионов металлов.
Существует мнение, что все, что способствует удалению анодных продуктов и их диффузии вглубь электролита затрудняет процесс электрохимполирования.
Существует гипотеза, закладывающая в основу электрохимической полировки диффузионно–адсорбционный процесс, который также предполагает наличие тонкого, плотного и вязкого слоя на границе металл–электролит. В нем происходят процессы миграции и диффузии продуктов анодного растворения в направлении от анода и акцепторов процесса по направлению к аноду, что было подтверждено Гриневич. Как и в предыдущих механизмах он образуется из продуктов анодного растворения, но с одним отличием. В процессе электрополировки в серной и фосфорной кислоте вода связывается с ионами металлов, которые затем переносятся в электролит в виде гидратированных ионов и комплексов. Дефицит воды, который еще больше усугубляется ее электролитическим разложением с выделением кислорода, приводит к возникновению условий, способствующих получению нерастворимых химических соединений, которые и образуют тонкую пленку в виде так называемого вязкого слоя. По мнению автора, образование пассивных слоев может еще больше затруднить перенос ионов. Высокое электрическое сопротивление электролита приводит к высокому тепловыделению в ходе полировки, что способствует конвекции. Конвекция усиливается за счет изменения плотности раствора.
В ряде работ исследовалось влияние поверхностноактивных веществ на механизм полирования. Поверхностно-активные вещества, с одной стороны, являются основой для формирования вязкой пленки путем взаимодействия с продуктами анодного растворения, а, с другой стороны, адсорбируются преимущественно во впадинах поверхности и на границах кристаллитов. Это приводит к возникновению большего скачка потенциала во впадинах при наложении анодного тока и обуславливает их более глубокое пассивирование. В результате этого, по мнению авторов, создаются благоприятные условия для преимущественного растворения выступов поверхности.
Краткое изложение моделей электрохимического полирования, основанных на существовании вязкого слоя, был представлен Лином и Ху. Авторы логически объединили гипотезы, рассмотренные выше, приняв во внимание молекулярное взаимодействие между частицами воды, с которыми соединены ионы металлов, и присутствие кислот и добавок, повышающих вязкость раствора. Авторы разделили слой, который образовался между анодной поверхностью (E) и глубиной раствора (слой A), на три зоны B, C и D, различающиеся концентрацией компонентов (рисунок 3).

Рисунок 3 - Модель анодного растворения в процессе электрохимической полировки: 1 - направление движения акцепторов, 2 - направление движения ионов металлов.
Растворение подложки Е, массоперенос в процессе электрохимической полировки зависит от градиента концентраций, который существуют в слоях B и C и от микроструктуры слоев. Структура слоев зависит от типа используемого раствора и режима электролиза. Ионы металлов мигрируют и диффундируют из слоя D в глубину раствора A под действием электростатических сил и благодаря градиенту концентрации.
Слой D представляет собой слой нерастворенных солей металлов, которые образуются в результате осаждения фосфатов и сульфатов, которые являются продуктами реакции с компонентами ванны — фосфорной и серной кислотой. Слой С - это жидкий слой, содержащий концентрированные соли металлов, вплоть до насыщения. Если процесс электрополировки протекает по акцепторному механизму, то происходит диффузия акцепторов к аноду и миграция связанных в комплексы ионов металлов с анода в слой В. Следовательно, микроструктура слоя В формируется за счет массопереноса, связанного с этими процессами. Слой D исчезает и воспроизводится, в то время как слои B и C являются жидкими и сохраняются.
Этот механизм применим к хромистой стали, электрохимически отполированной в кислотах с низким содержанием воды в качестве акцептора. При использовании ванн, содержащих глицерин, в слое В могут образовываться полимерные структуры или агрегаты. Это является результатом присутствия трех функциональных групп -ОН- в частице глицерина, которые могут формировать прочные водородные связи. В результате усиливается эффект, препятствующий диффузии акцепторов к подложке (Е) и миграции ионов в глубину раствора (А). В соответствии с этим механизмом покрытие поверхности подложки (Е) полимерными агрегатными структурами (например, частицами глицерина) влияет на скорость растворения стали. Эти структуры хорошо сорбируются на поверхности оксидов, образующихся в условиях, далеких от термодинамического равновесия травления металла. В смещении потенциала анода от равновесного состояния большую роль играют как раз сорбирующиеся амины и мультиспирты.
Именно значительное смещение анодного потенциала и является важным условием для качественной электрохимической полировки: тогда процесс растворения анода не определяется чисто активными центрами кристаллической решетки, а начинает играть определенную роль и топография поверхности.
Некоторыми авторами, например Н. П. Федотьев и С. Я. Грилихес, объясняется эффект полирования образованием на металле поверхностной тонкой оксидной пленки в условиях пассивации, предотвращающей или тормозящей травящее воздействие на металл. Эта пленка лабильна и находится в состоянии динамического равновесия в результате двух противоположных процессов: электрохимического образования оксида и его химического разложения (“осцилляторный механизм”). Предполагается, что потенциал, необходимый для выделения кислорода, достигается раньше в микровпадинах. В условиях выделяющегося кислорода на поверхности микровпадин образуется пассивная пленка, затрудняющая растворение металла. Большая склонность углублений к пассивированию по сравнению с выпуклыми участками доказывается рядом работ по анодной пассивности. На выступах образование пассивной пленки происходит быстрее, но из-за резкого падения плотности тока на них там начинает преобладать процесс ее химического растворения. Частицам воды и анионам легче проникать на участки, расположенные на вершинах поверхности, скорость реакций там увеличивается, что, в свою очередь, также приводит к уменьшению там толщины оксидного слоя. Т.е. на выступах пленка реально оказывается тоньше, что создает лучшие условия для растворения металла. Плотность тока для полировки, поэтому, должна быть такой, чтобы вызывать частичную пассивность, не останавливающую травление полностью, но регулирующую ее. Оксидный слой при частичной пассивации проводит ток и характеризуется переменной толщиной, которая зависит от продолжительности процесса и формы анодной поверхности.
Таким образом, учитывая, что толщина пленки неодинакова на микровыступах и микровпадинах, раствор сильнее травит микровыступы, где толщина пленки меньше. В результате этого процесса и сглаживаются мельчайшие неровности на поверхности металла.
Исходная структура обрабатываемого металла или сплава влияет на чистоту поверхности после электрохимической полировки. Преимущественное растворение происходит на участках химических, структурных и микрогеометрических неоднородностей, где пассивирующий слой менее совершенен.
Согласно некоторым работам при приближении ко дну впадины переход металла из активного состояния в пассивное обусловлен резким торможением процесса ионизации металла вследствие образования фазовых оксидных и гидроксидных или адсорбционных пленок.
Существуют исследования полупроводниковых свойств образующейся оксидной пленки. Механизм сглаживания макрорельефа авторы связывают с сопротивлением пленки, а возникновение блеска – с составом, природой, электрофизическими свойствами оксидной пленки и процессами, протекающими на границе «пленка– электролит».
Предложена также гипотеза о возможности разрушения пассивных пленок за счет их электрического пробоя вследствие крайней неоднородности электрического поля и изменения поверхностного натяжения пленок на выступах профиля поверхности.
По мнению другой группы авторов, сглаживание шероховатости поверхности происходит в результате преимущественного растворения активных участков поверхности, к которым относятся несовершенные элементы кристаллической решетки поверхностного слоя – грани кристаллов, углы, ребра, выступы шероховатой поверхности, обладающие большей энергией и поэтому растворяющиеся в первую очередь. Преимущественное растворение этих элементов поверхности приводит к образованию закономерно расположенных мельчайших фигур травления, что и является причиной повышения отражательной способности поверхности. Авторы полагают, что активные участки могут оказаться и во впадинах профиля, в результате чего при электрополировке не происходит полного сглаживания шероховатости поверхности. Авторы установили, что решающим фактором в достижении блеска поверхности является ее предварительное текстурирование, повышающее электрохимическую однородность металла. Отмечается важная роль диффузионных ограничений по акцепторам, что обеспечивало постепенное уменьшение масштабов структур травления в глубину.
Работами многих исследователей установлено, что после электрохимполировки часто получается матовая поверхность, но с низкой шероховатостью, а иногда при незначительном сглаживании неровностей – поверхность с высоким блеском, т.е. одновременно обеспечить высокий блеск и необходимую шероховатость поверхности удается не всегда. Установлено, что механизмы сглаживания неровностей и получения высокого блеска имеют разную физическую природу. Сглаживание неровностей связано с макро- и микролокальным растворением, подавлением травления за счет наступления пассивности и диффузионной кинетикой. Повышение блеска обусловлено растворением наиболее активных участков поверхности, что связано с концентрацией дефектов в кристаллической решетке металлов и их выходом на поверхность граней определенной ориентации. Наибольший блеск поверхность приобретает при минимальной толщине оксидной пленки, которая, тем не менее, должна быть достаточной для предотвращения травящего действия электролита на металл.
Ход процесса электрохимической полировки также может быть проанализирован с точки зрения энергетических потребностей фазы ионизации атомов растворенного металла. Энергия, необходимая для ионизации поверхностного атома во время анодного растворения, является самой низкой на пиках и самой высокой в углублениях.
Таким образом, все гипотезы о электрохимическом полировании металлов можно разделить на три группы:
- Диффузионные гипотезы, связанные с образованием и главной ролью в ходе сглаживания поверхности вязкой пленки из продуктов растворения основы. Первая группа основывается, по сути, лишь на концентрационных изменениях в прианодном слое. Экспериментально она недостаточно обоснована. Большинство исследователей согласны с тем, что при вязкий слой играет большую роль в сглаживании макронеровностей до 100 мкм, но выглаживание субнеровностей нельзя объяснить только различиями сопротивлений прохождению тока от электролита до выступов и впадин или скоростей диффузии от этих участков профиля поверхности по причине несущественного различия в размерах выступов и впадин.
- Пассивационные гипотезы, также признающие существование вязкой пленки, но главную роль отдающие пассивации поверхности анода.
- Электродекристаллизационные гипотезы, рассматривающие процесс растворения металла как декристаллизацию, что противоположно катодной кристаллизации в гальванике. Ключевой момент здесь – реакции на активных центрах анода.
В конечном счете все гипотезы сводятся к неодинаковому энергетическому состоянию поверхности выступов и углублений в процессе электролиза, что обусловливает различие в скорости их растворения.
3. Кинетика электрохимического полирования.
Анодная поляризация – основной инструмент управления электрохимической полировки. Ход процесса описывает потенциодинамическая поляризационная кривая “анодный потенциал - плотность тока” (условно – на рисунке 4).
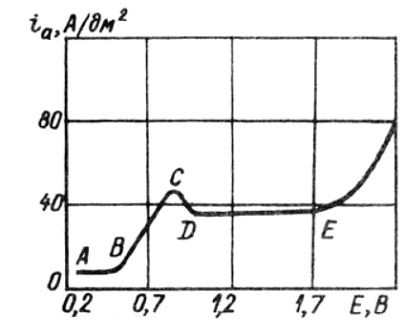
Рисунок 4 - Анодная поляризационная кривая при электрохимическом полировании
- Первый подъем поляризационной кривой соответствует процессу анодного растворения металла. Концентрация ионов металла в прианодном слое электролита увеличивается. На участке ВС скорость диффузии продуктов анодного растворения больше, чем скорость анодного растворения металла. По мере приближения к точке С эта разница уменьшается.
- На участке CD скорость растворения превышает скорость диффузии. Продукты анодного растворения накапливаются на поверхности анода, в результате чего увеличивается сопротивление слоя у анода и падает сила тока.
- На участке DE напряжение возрастает при постоянной силе тока, т. е. масса растворяющегося при этом металла не меняется. Повышенная гладкость анодной поверхности способствует повышению плотности тока (уменьшается эффективная площадь анода). Далее с ростом напряжения пленка продуктов растворения становится прочнее и повышается сопротивление.
- В точке Е кривая круто поднимается вверх, начинается разряд ионов гидроксида и выделение газа. Полированная поверхность чаще всего получается после перегиба кривой в точке Е, хотя в отдельных случаях полирование меди и ее сплавов в ортофосфорной кислоте происходит и на горизонтальном участке. Если после точки Е образуется сплошная беспористая пленка, то прохождение тока прекращается из-за ее высокого сопротивления. Если пленка пористая, то сила тока определяется электропроводностью слоя на участке пор.
На рисунке 5 приведены кривые зависимости анодного потенциала от плотности тока для меди в растворах фосфорной кислоты различной концентрации.
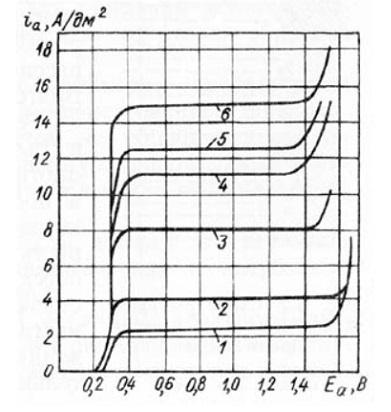
Рисунок 5 - Зависимость потенциала анода от плотности тока при электрополировании меди в фосфорной кислоте при температуре электролита 30 °С и плотности растворов (г/см3): 1 - 1,55; 2 - 1,52; 3-1,40; 4 - 1,30; 5 - 1,20; 6 - 1,10.
Горизонтальный участок наиболее резко выражен в концентрированных растворах. При разбавлении кислоты горизонтальные участки сужаются. С повышением температуры возрастают значения плотности тока, которым соответствуют горизонтальные участки кривых анодной поляризации. Перемешивание электролита оказывает такое же влияние на плотность тока, как и повышение температуры.
Электролиты, пригодные для электрополирования, должны удовлетворять следующим требованиям:
- обеспечивать образование вязкой пленки на поверхности деталей;
- иметь длительный срок службы;
- не оказывать разрушающего действия на полируемый металл при отсутствии тока;
- обладать широким рабочим интервалом тока, причем применяемая плотность тока, напряжение и температура не должны быть чрезмерно высокими.
Наибольшее распространение в качестве электролита для электрополирования получили фосфорная, серная и хромовая кислоты с добавками и без них.
В электролит часто вводят глицерин, метилцеллюлозу для повышения вязкости растворов и ингибиторы травления для предотвращения разъедающего действия электролита на поверхность полируемых деталей. В большинстве случаев применяют концентрированные растворы, вода обычно вводится для некоторого повышения электропроводности и снижения напряжения.
Влияние введения ионов шестивалентного хрома при электрополировании меди на ход поляризационной кривой показано на рисунке 6.
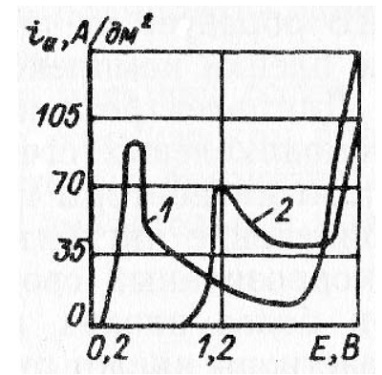
Рисунок 6 - Влияние иона Сr6+ на анодную поляризацию при электрохимическом полировании меди в электролитах состава (масс. доля): 1 - Н3РО4 - 0,80, H2SO4 - 0,12, Н2О - 0,08; 2 - Н3РО4 - 0,78, H2SO4 - 0,10, CrO3 - 0,06, Н2О - 0,06
Введение этих ионов приводит к повышению предельного тока и смещению потенциала меди в сторону положительных значений. Предполагают, что в растворах, содержащих окислитель, например хроматы, он принимает участие в формировании оксидной пассивирующей пленки, тормозящей процесс травления, и облегчает ее образование.
Добавление в электролит органических ПАВ оказывает также положительное влияние на процесс электрополирования: введение ПАВ (1-1,5 г/л) позволяет снизить плотность тока, расход электроэнергии и температуру электролита. Кроме того, появляется возможность полировать труднополируемые (полуферритные) марки стали.
Предполагается, что ПАВ оказывают влияние на формирование адсорбционных пленок на поверхности стали. Возможно, что ПАВ образует на поверхности коррозионно-стойкой стали фазовые пленки комплексов ионов металлов с ионами ПАВ.
Для электрохимического полирования хрома, хромистых и хромоникелевых сталей в растворы фосфорной и серной кислот вводят ингибиторы травления: сульфоуреид, триэтаноламин и др. Применение ингибиторов коррозии способствует улучшению антикоррозионных свойств металла и позволяет вести электролиз при более низких плотностях тока. Таким образом, введение в растворы кислот окислителей и органических соединений благоприятно сказывается на качестве поверхности металла.

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



