
Химическое полирование металлов
Среди немеханических способов полировки металлов выделяют химическую и электрохимическую.
В зависимости от толщины снимаемого слоя поверхности и поставленных задач различают следующие методы обработки при химической полировке:
- глянцевание, которое придает блеск поверхности и выравнивает субнеровности при толщине снимаемого слоя менее 1 мкм;
- полирование, которое сглаживает неровности при толщине снимаемого слоя от 1 до 10 мкм;·
- шлифование (химический ремонт), при котором снимаемый слой металла имеет толщину от 10 до 200 мкм и выше, и одновременно сглаживаются неровности поверхности.
В большинстве случаев, химическая полировка используется для декоративной отделки поверхности деталей, подготовки поверхности перед осаждением гальванических покрытий и удаления мелких заусенцев.
Основные преимущества химической полировки:
- В отличие от механической обработки, производительность химической полировки не зависит от физико-механических свойств металла и конфигурации заготовки. В некоторых случаях она даже превышает производительность механических методов.
- После химической полировки на поверхности деталей меньше оседает и удерживается загрязнений из-за особенностей рельефа.
- Поверхность становится более устойчивой к коррозии.
- Химическая полировка устраняет дефектный поверхностный слой металла, возникший после предварительной механической обработки.
- В особых условиях, в которых работает пневмогидроаппаратура и клапаны искусственного сердца, надежность работы изделий повышается после химической полировки. Физико-механические свойства поверхности также улучшаются.
- Процесс химической полировки прост и не требует значительных капитальных вложений.
Недостатки химической полировки:
- низкая живучесть растворов (6-18 дм2/л), высокая стоимость как самих растворов, так и их утилизации, отсутствие возможности корректировки;
- невозможность регулирования толщины удаленного слоя металла и, в результате, невозможность полирования прецизионных деталей;
- использование концентрированных кислот, вредных веществ и выделение вредных, токсичных газов (NO, NO2), паров кислот в больших объемах.
Недостаточная информация о теоретических основах механизма химической полировки является одной из главных причин ее ограниченного применения для сплавов на основе железа, хрома и никеля в промышленных масштабах. В то же время химполировка меди дает неплохие результаты. По сравнению с электрохимической полировкой химполировка позволяет получить меньшую отражательную способность, относительное сглаживание и минимально достижимую шероховатость поверхности более Ra 0,2 мкм.
В основе саморастворения металла в среде лежит механизм многостадийной электрохимической коррозии. По этому признаку электрохимическое и химическое полирование являются аналогичными процессами. При этом химическую полировку можно рассматривать как частный случай электрохимической. В обоих случаях происходит анодное растворение металла в первую очередь на микровыступах, что приводит к сглаживанию поверхности и повышению ее отражательной способности. Однако, в отличие от электрохимической полировки, при химической растворение металла происходит за счет токов саморастворения в присутствии окислителей без применения внешнего источника тока.
Электрохимическое растворение металла (Me) происходит при установлении необратимого электродного потенциала. Это происходит в несколько стадий.
Анодную стадия заключается в образовании сольватированных ионов металла (Men+ * mH2O) в электролите, а также электронов на поверхности металла:
Me + mH2O = Men+mH2O + ne
Ассимиляция электронов на катодной стадии происходит путем их соединения с ионами (не данного металла) или молекулами раствора, которые являются деполяризаторами (окислителями). Окислители D способны к восстановлению по реакции
ne + D = [Dne]
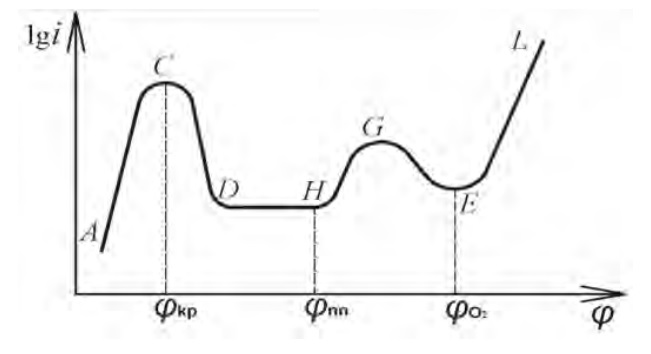
На рисунке 1 приведена схематически анодная поляризационная кривая пассивирующегося металла.

Рисунок 1 - Зависимость скорости коррозии i от потенциала φ.
Кривая имеет следующие участки:
- AC - участок описываемом уравнением Тафеля. На нем идет растворение с заметной скоростью, металл полностью активен. С ростом анодного потенциала скорость электрохимической реакции будет логарифмически расти до достижения критического потенциала φкр.
- CD – переходная область. При дальнейшем росте потенциала положительнее φкр скорость растворения металла упадет. Это связывается с адсорбцией кислорода на поверхности и блокировкой активных центров металла. При дальнейшем повышении потенциала поверхность закроется пассивным слоем полностью.
- DH – область пассивного состояния. В этой зоне скорость растворения металла незначительна, увеличение потенциала еще больше в положительную сторону не приводит к ее увеличению.
- HG – область перепассивации/транспассивного состояния (только для некоторых металлов). Начинается при достижении и превышении потенциала перепассивации φпп. Металлы при этом переходят в раствор в виде комплексов, имея более высокую степень окисления, чем в области AC.
- GE – область за зоной перепассивации. Анодная реакция снова затормаживается. В точке E с потенциалом φO2 начинается выделение кислорода.
- EL – вновь логарифмическая анодная кривая.
Активное растворение металла последовательно многостадийно. В нем участвуют компоненты раствора:
- Адсорбция анионов раствора mA на поверхности металла Me с образованием поверхностного комплекса металла (MeAm)адсm−
Me + mA− ⇄ (MeAm)адсm−;
- Электрохимическая стадия, определяющая переход поверхностного комплекса (MeAm)адсm− в раствор и скорость всего процесса:
(MeAm)адсm− → (MeAm)(m−n) + ne−;
- Распад комплекса (MeAm)(m−n) в растворе на простые ионы – катионы Men+ и анионы mA−
(MeAm)(m−n) ⇄ Men+ + mA−
Самопроизвольная анодная реакция осуществляется за счет ионизации металла, а самопроизвольная катодная – за счет восстановления кислорода, ионов водорода, молекул воды и других компонентов–окислителей, присутствующих в растворе.
Перейдем теперь непосредственно к механизму химического полирования. Основные разработки по химической полировке железа, хрома, никеля и их сплавов связаны с концентрированными составами на основе серной, азотной, соляной, фосфорной, фтористоводородной, щавелевой и уксусной кислот с окислителями, например, перекись водорода и хромовый ангидрид. Во всех этих растворах получаемая после обработки отражательная способность поверхности низкая, шероховатость снижается до Ra 1,25–0,63 мкм.
В кислотных растворах на основе азотной, соляной, серной или ортофосфорной кислот с добавками водорастворимых полимеров и ПАВ результаты лучше, но только для нержавеющей стали.
Существует несколько аспектов теорий химического полирования металлов, что в той или иной степени связано с явлением пассивации, рассмотренном выше.
- Адсорбционно-пленочная теория. В приповерхностном слое образуется вязкий слой продуктов реакции. Эффект полирования совпадает с образованием на поверхности оксидной пленки и последующим ее восстановлением, в частности, азотистой кислотой. Травление под действием микрогальванопар подавляется отдельными добавками-ингибиторами. Ингибирование объясняется адсорбцией добавок на активных анодных участках микрогальванопары.
- Теория пассивирующих пленок. Местные коррозионные токи, вызванные микрогальванопарами, способствуют созданию на поверхности металла оксидного пассивирующего слоя, который оказывает значительное влияние на растворение металла. Процесс химической полировки связан с диффузионными ограничениями в приповерхностном слое и непрерывным формированием/растворением тонкой оксидной пленки. Для достижения эффекта полирования скорости этих процессов должны быть близки.
- Теория активного растворения металла (при химическом полировании сталей 10, 12Х18Н10Т и ЭИ-448 в водных растворах серной, азотной и соляной кислоты с добавками полиакриламида, ОП-10 и красителя кислотного оранжевого). В теории было установлено и подтверждено экспериментально, что блескообразование в процессе химического глянцевания наблюдается в области активного растворения металла (область АС на рисунке 1). Оно идет за счет сглаживания субнеровностей благодаря образованию на поверхности металла пленок хелатных комплексных соединений. При химическом шлифовании и полировании основные процессы также идут в области активного растворения металла. При этом комплекс водорастворимых органических соединений способствует образованию вязкого диффузионного слоя, который накапливается во впадинах профиля поверхности, где растворение металла протекает с диффузионными ограничениями. Т.е. затормаживается. Сглаживание поверхности обусловлено большей доступностью выступов с точки зрения диффузии и прекращается тогда, когда радиус кривизны выступов становится равным толщине диффузионного слоя.
Таким образом, механизм химполирования имеет э/х природу, основанную на коррозионных процессах. Повышение степени блеска поверхности связано с подавлением травления и образованием пассивных пленок, улучшающих электрохимическую однородность поверхности. Выраженное сглаживание же связано с наличием диффузионных ограничений.
| Компонент растворов | Номер раствора | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| г/л | массовая доля, % | объемная доля, % | Массовая доля, % | г/л | ил | ||||
| Фосфорная кислота | 930-950 | 1300-1400 | - | - | 60-65 | 59-67 | 1300-1400 | 1500-1600 | 780 |
| Серная | - | - | - | 1,8 | - | - | 200-250 | - | 160 |
| Азотная | 280-290 | - | 2,2 | - | 10-12 | 18-22 | 110-150 | 60-80 | 60 |
| Соляная | - | - | - | - | - | - | - | - | - |
| Уксусная | 250-260 | - | - | - | 23-25 | 15-19 | - | - | - |
| Азотнокислый калий | - | 450-500 | - | - | - | - | - | - | - |
| Перекись водорода | - | - | 10,5 | 10,5 | - | - | - | - | - |
| Спирт этиловый | - | - | 2,8-3,0 | 2,8-3,0 | - | - | - | - | - |
| Карбоксиметилцеллюлоза | - | - | - | - | - | - | 0,8 | - | 0,8г |
| Азотнокислая медь | - | - | - | - | - | - | - | - | 5г |
| Борная кислота | - | - | - | - | - | - | - | - | 5г |
| Тиомочевина | - | - | - | - | - | 0,01 | - | - | - |

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



