

Общие сведения о методах нейтрализации сточных вод гальванического производства.(ч.2)
Первая часть этой статьи:
Общие сведения о методах нейтрализации сточных вод гальванического производства.(ч.1)
2.4 Электрохимические методы.
2.4.1 Прямой электролиз.
Прямой электролиз заключается в разряде ионов тяжелых металлов на катоде. При этом происходит либо осаждение металлов в виде порошка / компактного осадка, либо понижение степени окисления (восстановление) до менее токсичного или удобного для доочистки состояния. Во втором случае ионы остаются в растворе и для исключения их обратного окисления анодное пространство отделяют от остальной части электролита мембраной (диафрагмой).
Прямым электролизом может быть извлечена медь.
Известен метод регенерации шестивалентного хрома из его трехвалентных соединений, содержащихся в сточных водах гальванических цехов, на свинцовых электродах в электролизерах, имеющих полупроницаемую анионселективную перегородку из политетраортоэтилена. На свинцовом аноде трехвалентный хром окисляется до шестивалентного и возвращается в технологический процесс.
Для практически аналогичных сточных вод, содержащих, г/л: 40-60 хромовой кислоты, 24-60 серной кислоты, 80-140 сернокислого хрома, 100-150 сернокислой меди, предложены и иные двухстадийные электрохимические технологии. Например, в электролизере с графитовыми электродами на первой стадии, в соответствии со значениями окислительно-восстановительных потенциалов, на катоде последовательно восстанавливаются хром, медь, водород по реакциям:
CrO42- + 8H+ +3e → Cr3+ + 4H2O E0 = +1,33B
Cu2+ + 2e → Cu0 ↓ E0 = +0,34B
2H+ + 2e → H2 E0 = 0,00B
Обработанный таким образом раствор, содержащий в основном ионы Cr3+, затем передается в анодную камеру второго электролизера, имеющую пористую перегородку из стекла. В этом электролизере катод выполнен из графита, анод - из свинца. Свинцовый электрод имеет высокое перенапряжение выделения кислорода, поэтому на нем более эффективно идет окисление трехвалентного хрома в шестивалентный. Пористая перегородка способствует проведению необратимого окисления.
Электролиз применяется также как метод изменения (электрохимически) величины рН сточных вод при их очистке от ионов тяжелых металлов. Это позволяет избежать увеличения солесодержания очищенной воды. В этой технологии широко применяются мембранные электролизеры. Разработаны технологические схемы очистки промышленных сточных вод гальванических производств от ионов Cu2+ , Ni2+ , Zn2+, Cr6+ с одно- и двухступенчатым регулированием рН.
Особенностью электрохимических методов нейтрализации и регенерации стоков является то, что знак заряда ионной формы металла зависит от вида и концентрации лигандов, присутствующих в растворе. Этим определяется, будем ли мы иметь дело с катодным процессом (восстановление) или анодным (окисление), т.е. уже на этом этапе становиться ясной необходимость детального термодинамического анализа распределения форм тяжелых металлов в сточных водах.
2.4.2 Электродиализ.
Интересным является такой электрохимический метод как электродиализ. При электродиализе происходит разделение стоков на концентрат и оборотную воду. Технически установка представляет собой электролизер, пространство в котором разделено мембранами по схеме:
[катод (-) // кат. мембр. // анион. мембр. //кат. мембр. // ... // анион. мембр. // анод (+)]
Мембран может быть несколько (минимум две), они располагаются в порядке чередования по типу. Обязательным является тот момент, что перед катодом должна быть катионитовая мембрана, а перед анодом - анионитовая.
Катоды - нержавеющая сталь или титан, аноды - платинированный титан или графит.
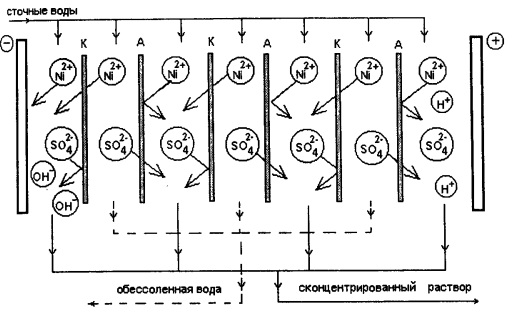
Ионы начинают двигаться под действием электрического тока, но могут пройти только через определенную мембрану. В результате в четных камерах образуется обессоленная вода, а в нечетных - концентрат. Электродиализом можно вернуть в производство до 60% воды. Он не дает шламов. Требования к этому методу во многом схожи с требованиями к ионному обмену и мембранным технологиям.
Следует заметить и невозможность работы электродиализной установки с высокими концентрациями загрязнителей в сточной воде, а необходимость утилизации вышедших из строя мембран создает дополнительную экологическую проблему.
2.4.3 Электрокоагуляция и гальванокоагуляция.
Широко рекламировались в свое время методы электро- и гальвано- коагуляции. Они применяются и сегодня, но их эффективность многими специалистами ставится под вопрос ввиду образования в результате нейтрализации стоков огромного количества неликвидного аморфного гальваношлама. Защитниками этих методов являются Селицкий Г.А., Анапольский В.Н., противниками - Кудрявцев В.Н., Кругликов С.С., Виноградов С.С.
Суть электро- и гальванокоагуляции заключается в том, что при прохождении сточной воды через межэлектродное пространство или реакционную массу происходят процессы, сопровождающиеся генерацией частиц (в основном железосодержащих), при взаимодействии с которыми коллоидные частицы гидроксидов металлов теряют устойчивость и коагулируют. Если же речь идет о нейтрализации хромсодержащих стоков, то здесь параллельно происходит восстановление хрома (VI) до хрома (III) свежесинтезированными ионами железа (II).
Различия между электро- и гальванокоагуляяцией состоят в способе ионизации железа - первый метод подразумевает его растворение под действием внешнего электрического тока (при этом исходно используются стальные пластины), а второй - растворение за счет внутреннего электролиза в гальванопаре железа с более положительным элементом. Здесь в качестве второго компонента применяют медь или кокс, а основным сырьем выступает стальная стружка.
В результате проведения очистки электро-гальванокоагуляцией образуется огромное количество обводненного аморфного гидроксида железа, содержащего относительно небольшое количество других тяжелых металлов.
В основе электрокоагуляции лежит ряд физико-химических процессов, протекающих в жидкости под воздействием электрического тока: электростатические, электрохимические, электролитические, гидродинамические, концентрационные.
Механизм электрокоагуляции до сих пор недостаточно изучен, имеется две основных теории.
Первая основывается на явлении специфической адсорбции многозарядных ионов частицей с последующим изменением заряда ее поверхности, приводящей к коагуляции. Вторая - на образовании слаборастворимых соединений металлов, которые взаимодействуют с коллоидными частицами, имеющими противоположный заряд поверхности.
Гальванокоагуляция по механизму похожа на электрокоагуляцию, но с указанными выше отличиями. Кроме этого, в механизме гальванокоагуляции отсутствует электростатическая составляющая.
Метод гальванокоагуляции позволяет проводить очистку сточных вод от различных примесей: ионов меди, никеля, цинка, хрома, мышьяка, кадмия, кобальта, свинца и других металлов, органических веществ, растворенных и эмульгированных нефтепродуктов.
О.О. Виноградова, В.И. Погорелов и В.А. Феофонтов предлагают для этого способ, основанный на использовании эффекта работы короткозамкнутой гальванической пары Fe/C (Al/C), помещенный в очищаемый раствор в аппарате барабанного типа, и на образовании ферромагнитных, оксидных форм железа и гидроксида алюминия, получаемых в этих аппаратах.
В процессе растворения железа кислота, присутствующая в растворе, нейтрализуется и происходит восстановление элементов высшей валентности до соединений низшей валентности. Последние образуют с магнетитом нерастворимые соединения типа ферритов (МеFe2О4).
А.И. Гладышев и др. для очистки сточных вод завода «Рязаньцветмет», содержащих ионы мышьяка и тяжелых металлов, разработали технологическую схему, включающую усреднение, подкисление, гальванокоагуляцию, корректировку рН среды и фильтрование. Предлагается использовать промышленный гальванокоагулятор КБ-1. Основная масса ионов металла переходит в твердую фазу в процессе коагуляции даже слабокислой среде.
Существует ряд технологических отличий между электро- и гальванокоагуляцией:
1. Электрокоагуляция выполняется в стационарных электролизных ваннах, гальванокоагуляция - в насыпных установках вращающегося типа.
2. При электрокоагуляции можно отрегулировать плотность тока и, следовательно, количество растворенного железа. Это делает процесс более гибким и эффективным.
3. Электрокоагуляция более предсказуема, для нее разработано множество математических моделей протекания процесса.
4. При электрокоагуляции Fe(II) полностью идет на реакцию с Cr(VI), в гальванокоагуляции же часть Fe(II) реагирует с кислородом (часть реакционной массы периодически возвышается над уровнем электролита при вращении, за счет чего происходит активное окисление железа и насыщение раствора кислородом воздуха). Следовательно, электрокоагуляция позволяет экономить железо и получать меньше шлама.
5. Процесс гальванокоагуляции может сильно тормозиться от присутствия в растворе пассивирующих железо анионов.
6. Электрокоагуляторы проще в обслуживании.
Достоинства электрокоагуляции:
- Возможность достижения норм ПДК;
- Возможность перерабатывать с хорошей скоростью большие объемы стоков;
- Относительная простота оборудования;
- Потребность в небольшом количестве площадей;
- Небольшие затраты на реактивы.
Достоинства гальванокоагуляции:
- Основной расходный материал - стальные отходы;
- Низкая энергоемкость и эксплуатационные затраты;
- Высокая производительность.
Недостатки же электро- и гальванокоагуляции настолько сильны, что ставят под сомнение саму целесообразность их применения:
- ПДК по хрому для рыбохозяйственных водоемов недостижим.
- значительный расход электроэнергии при электрокоагуляции;
- железо во многих случаях склонно к пассивации;
- высокое содержание фоновых солей в очищенной воде, что не позволяет использовать ее повторно;
- получаемые в огромном количестве гальваношламы содержат избыток железа и незначительное количество более ценных компонентов, что, одновременно с их аморфностью и сильной обводненностью делает их непригодными для сколь-нибудь экономически выгодного использования в дальнейшем. Например, при нейтрализации хромсодержащих сточных вод при электрокоагуляции образуется 10 кг гальваношлама на 1 кг трехвалентного хрома (в пересчете на сухой вес). При этом тратится 5 кг железа и несколько килограмм кислот и щелочей;
- в связи с предыдущим недостатком возникает и потребность в больших площадях для шламоотвалов;
- стоки перед очисткой необходимо разбавлять до сотен миллиграмм на литр (невозможно работать с высококонцентрированными стоками). Также необходимо строго соблюдать рН.
- в гальванокоагуляционных установках также возникает повышенная трудоемкость при сменен загрузок стальной стружки.
2.4.5 Контактный обмен (цементация).
При очистке промышленных сточных вод широко применяются реакции контактного обмена (цементация (не путать с химико-термическим процессом насыщения поверхности стали углеродом)). Цементация - это электрохимический метод извлечения цветных металлов из водных растворов, заключающийся в их обработке более активным металлом, например железом. Цементация проходит за счет внутреннего электролиза под действие разности потенциалов двух металлов (т.е. без внешнего тока).
Процесс цементационного извлечения меди активным железом описывается реакцией:
Cu2+ + Fe0 → Cu0 + Fe2+
В этом случае медь осаждается на поверхности активного железа.
В случае присутствия в воде шестивалентного хрома возможно прохождение следующих реакций:
2Cr6+ + 3Fe0 → 2Cr3+ + 3Fe2+
Cr6+ + 3Fe2+ → Cr3+ + 3Fe3+
2.4.6 Электрофлокуляция.
Достаточно экзотическим является метод электрофлокуляции. Электрофлокулятор - это электролизер, где катод - частички железа, а анод - частички железа с алюминием. В процессе электролиза синтезируется флокулянт, который сорбирует ионы тяжелых металлов. Данных о серьезном применении этой технологии в промышленном производстве не найдено.
В целом большинство электрохимических методов (кроме прямого электролиза) дороги, требуют высокой культуры производства, высокой квалификации персонала, невысокой концентрации загрязнителей в стоках.
Читайте также статьи
Влияние меди на организм
Воздействие меди на организм человека. Польза и вред.
Влияние хрома на организм
Воздействие хрома на организм человека. Польза и вред.
Влияние тяжелых металлов на организм
Вред для здоровья человека от тяжелых металлов

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



