

Цинковые аноды для гальваники
Цинкование является самым распространенным защитным покрытием в промышленности.


Поэтому и цинковые аноды являются одними из самых ходовых в гальванотехнике. Они выпускаются как в виде пластин, так и насыпью: сферами, полусферами и цилиндрами. Ввиду того, что при цинковании аноды весьма склонны к пассивации при высоких анодных плотностях тока, применение насыпных анодов в титановых корзинах более выгодно (их удельная площадь выше). Кроме этого, при работе насыпных анодов не образуется анодных остатков ("обсосков").
ГОСТ 1180-91 Аноды цинковые. Технические условия
|
Марка |
Zn, % |
Максимальное содержание примесей, % |
|||||||
|
Pd |
Cd |
Fe |
Cu |
Sn |
As |
Al |
Сумма |
||
|
Ц0 |
99,975 |
0,013 |
0,004 |
0,005 |
0,001 |
0,001 |
0,0005 |
0,005 |
0,025 |
|
Ц1 |
99,950 |
0,020 |
0,010 |
0,010 |
0,002 |
0,001 |
0,0005 |
0,005 |
0,050 |
Существуют как более загрязненные марки, не применяемые в гальванике, так и более чистые, которые также не дают значительного выигрыша, но повышают себестоимость цинкового покрытия.
Растворение цинковых анодов происходит в несколько стадий и носит сложный кинетический характер. Среди осложняющих факторов, затрудняющих описание данного процесса, можно выделить:
- Одновременное протекание химического и электрохимического растворения цинка;
- Замедленная диффузия продуктов растворения из прианодного пространства в объем электролита;
- Образование новых фаз;
- Массоперенос в твердой фазе.
В процессе химического растворения цинка в конечном счете образуются цинкатные гидроксокомплексы, а при электрохимической анодной реакции соединения Zn(OH)2 и ZnO, которые также в дальнейшем растворяются в электролите в избытке щелочи с образованием цинкатов. Отличием цинка при электрохимическом растворении от менее активных металлов является тот факт, что при увеличении его анодной поляризации увеличивается и его скорость саморастворения. Это явление сопровождается ростом скорости восстановления деполяризатора (ионов водорода) - т.н. отрицательный дифференц-эффект (ОДЭ).
ОДЭ объясняется несколькими теориями:
1. Непосредственное взаимодействие воды с цинком;
2. Непосредственное взаимодействие воды с частицами цинка, выкрошившимися из анода;
3. Стадийность ионизации цинка, переход его на аноде сначала в однозарядную форму Zn+, которая может доокисляться на электроде или в растворе до Zn2+ с образованием водорода.
При растворении цинковые аноды могут подвергаться пассивации, если анодная плотность тока превысит 2А/дм2, либо если состав ванны будет нарушен, например, при недостатке гидроксида натрия. При пассивации на аноде обратимо возникает слой труднорастворимых соединений цинка, который препятствует новым ионам цинка диффундировать в электролит, а гидроксид-ионам из электролита поступать к не окисленной поверхности анода. Этот слой носит адсорбционную природу и выражается составом е-Zn(OH)2. Адсорбированная частица гидроксида цинка может отдавать воду и превращаться в оксид ZnO. Внешне пассивная пленка выглядит как золотистый или фиолетовый налет. Полностью запассивированные цинковые аноды прекращают растворяться, на них начинает активно выделяется кислород, концентрация цинката и щелочи в ванне снижается. При увеличении концентрации щелочи в растворе пассивная пленка становится тоньше, а количество дефектов в ней увеличивается, что приводит к возрастанию коэффициента диффузии цинка.
Скорость растворения цинковых анодов зависит от потенциала и от концентрации щелочи (рисунок 1), в то же время концентрация ионов цинка никак не влияет на нее.
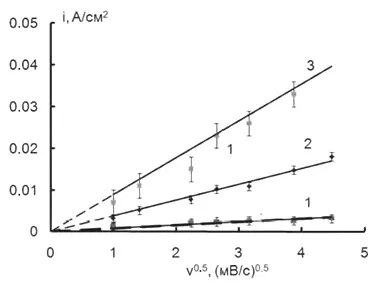
Рисунок 1- Влияние С(NaOH) на скорость растворения цинковых анодов при потенциале пика в растворах: 1 - 0,2М, 2 - 1М, 3 - 2М.
Рассмотрим механизм растворения цинковых анодов более подробно по стадиям:
1. Отрыв электрона от металлического цинка, присоединение гидроксид-аниона:
Zn + OH-адс ↔ [Zn(OH)]адс + e
2. Разряд адсорбированной частицы, дальнейшее взаимодействие с гидроксид-ионами:
[Zn(OH)]адс + 2OH-адс → [Zn(OH)3]-адс + e
[Zn(OH)3]-адс + OH-адс ↔ [Zn(OH)4]2-адс
По мнению некоторых авторов возможна реакция диспропорционирования (по аналогии с растворением медных анодов):
[Zn(OH)]адс + [Zn(OH)]адс → [Zn(OH)2 + Zn
3. Переход комплекса [Zn(OH)4]2-адс в раствор (замедленная диффузия). Параллельно может идти разложение комплекса за счет пересыщения приэлектродного пространства:
а. [Zn(OH)4]2-адс ↔ [Zn(OH)2]адс + 2OH-
одновременно может идти реакция разряда:
б. [Zn(OH)]адс + OH-адс → [Zn(OH)2]адс + е
или реакция отрыва воды:
в. [Zn(OH)]адс → ZnOадс + Н+ + е
H+адс + OH-адс ↔ Н2О
Реакции а, б, в приводят к пассивации цинковых анодов.
Кроме этого, возможна четвертая реакция, вносящая вклад в пассивацию цинка:
Zn + [Zn(OH)2]адс + 2OH- ↔ 2ZnOадс + 2H2O + 2e
При благоприятных условиях пассивная пленка растворяется по реакциям:
[Zn(OH)2]адс + 2OH-адс → [Zn(OH)4]2-адс → [Zn(OH)4]2-р-р
ZnOадс + 2OH-адс + 2H2O ↔ [Zn(OH)4]2-адс → [Zn(OH)4]2-р-р
В полностью же пассивном состоянии на цинковом аноде идет выделение кислорода.
Возможно также частично пассивное состояние, в котором одновременно протекают процессы и растворения цинка и выделения кислорода.
В целом можно сказать, что наилучшими цинковыми анодами являются те, которые растворяются равномерно, имеют малое количество примесей, хуже пассивируются при высоких анодных плотностях тока, а также не выкрашиваются при растворении (т.е. имеющие однородную мелкокристаллическую структуру)
Читайте также статьи
Техпроцесс гальванического цинкования
Что такое цинк, какие у него свойства? Техпроцесс и электролиты для цинкования.
Достоинства и недостатки цинкования
Описание процесса, его назначение. Преимущества и недостатки
Заказать гальваническое цинкование (Ц.хр)
Сделать заказ цинкования с сертификатом качества на заводе

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



