

Серебрение | Механизм и метод гальванического процесса. Структура и свойства серебряных покрытий.
Содержание:
2. Механизм серебрения из цианистого электролита.
1. Что такое серебро?
Серебро — мягкий, пластичный и ковкий драгоценный металл снежно-белого цвета. Стандартный электродный потенциал серебра по разным источникам равен 0,799-0,81 В, а его электрохимический эквивалент составляет 4,025 г/(А*ч).
Серебро имеет атомную массу 107,88, плотность 10,49 кг/м3 и температуру плавления 960,5°С. Теплопроводность серебра в пределах от 0 до 100°С равна 1 кал/(с*см*°С), удельное сопротивление 0,016 Ом*мм. Из всех металлов оно обладает наилучшей тепло- и электропроводимостью.
вердость самородного серебра равна 26 кгс/мм2. Микротвердость гальванически осажденных серебряных покрытий возрастает до 590-1370 МПа, а при наличии специальных добавок, вводимых в электролит серебрения, микротвердость возрастает еще в 1,5 - 2 раза.
Насколько серебро химически стойко?
Серебро растворяется в концентрированной азотной кислоте, царской водке, горячей 85% серной кислоте. Серебро неустойчиво в растворах аммиака. Кислород окисляет серебро только при давлении 1,5 МПа и температуре 300° С. Серебро быстро тускнеет в промышленной атмосфере в присутствии одновременно сернистых соединений, кислорода и влаги, покрываясь пленкой сульфидов коричневого и темно-серого цвета. Особенно активно в этом отношении гальванически осажденное серебро. Также серебро может тускнеть в присутствии органических серосодержащих материалов, если длительное время будет находиться вместе с ними в непроветриваемом помещении.
|
Обозначение (пример) |
Ср1; Ср3; Ср6; Ср9; Ср12; Ср15; Ср18; Ср21; Ср24; Ср27; Ср30 и тд; - стандартное серебрение Ср3.крц; Ср6.крц; Ср9.крц; Ср12.крц; Ср15.крц; Ср18.крц; Ср21.крц; Ср24.крц; Ср27.крц; Ср30.крц и тд; - серебрение с крацеванием silver coating - англ. обозначение |
|
Толщина |
3-50мкм (оптимально, возможна и большая толщина) |
|
Микротвердость |
883-1370 МПа, которая в течение времени может уменьшаться до 558 МПа |
|
Удельное электрическое сопротивление при 18°C |
1,6⋅10-8 Ом⋅м. |
|
Допустимая рабочая температура |
300°C |
Заметное изменение цвета поверхности серебра начинается с толщины сульфидов от 40 нм. При этом максимальная толщина сульфидной пленки составляет 0,3 мкм. Сами по себе пленки сульфида серебра термостойки до 885° С, не растворятся в кислотах и аммиаке, но неустойчивы в 5-10% цианидах.
Химическая активность серебряных покрытий возрастает на шероховатой поверхности.
Серебро устойчиво в соляной кислоте, щелочах, сухом сероводороде. По коррозионной стойкости оно приближается к благородным металлам, не окисляясь на воздухе при обычных условиях.
Во всех соединениях серебро одновалентно, хотя на сегодняшний день этот факт подвергается сомнению - под воздействием озона образуются оксиды двухвалентного серебра. С сероводородом в присутствии влаги и кислорода воздуха серебро образует нерастворимый в воде сульфид серебра. Пленка изменяет свой цвет от радужного через коричневый к черному. Она не разлагается до 885°С и растворяется только в азотной кислоте и аммиаке.
Все соли серебра чувствительны к свету и распадаются под его воздействием с образованием металлического серебра. Поэтому их хранят в непрозрачной таре, установленной в лабораторном шкафу с закрытыми дверцами, а приготовление электролитов ведут в ваннах с крышками или в затемненном помещении.

В чем особенности покрытий серебром?
Покрытия серебром являются катодными по отношению ко всем конструкционным материалам и не защищают их поверхность в условиях электрохимической коррозии.
В промышленности серебрение применяется:
- для создания поверхностных слоев высокой электропроводимости;
- для получения антифрикционного покрытия в подшипниках качения и скольжения, в т.ч. в вакууме, инертных средах, маслах;
- для обеспечения хорошей электропроводности в электрических контактах;
- при изготовлении отражателей, т.к. коэффициент отражения белого света для чистого серебра равен 95%;
- для защитно-декоративной отделки бытовых предметов и ювелирных изделий.
К негативным особенностям серебряных покрытий можно отнести:
- склонность к образованию наплывов на покрытии и свариванию контактов;
- плохая переносимость запрессовки в полимеры;
- возможность иглообразования;
- миграция по диэлектрику;
- диффузия на основной металл или на внешний слой покрытия.
Особенно следует рассмотреть вопрос переходного сопротивления электроконтактов с серебряным покрытием. Как упоминалось ранее, на серебряных покрытиях может образовываться сульфидная пленка. Эта пленка обладает ионной и фотоэлектрической проводимостью. Т.е. чем больше она освещена, тем меньшее ее сопротивление. Такая особенность электропроводимости сульфидов серебра приводит к серьезной нестабильности переходного сопротивления посеребренных электроконтактов в условиях эксплуатации. Если же на контакт приложена малая контактная нагрузка и через него пропускается низкий ток, то проводимость контакта может нарушиться полностью.
На сегодняшний день серебрение из водных растворов производят химически и электрохимически. В связи с тем, что потенциал серебра (+0.8В) намного положительнее потенциала других металлов, невозможно получить прочно сцепленные мелкокристаллические покрытия из растворов простых солей серебра без добавок. На катоде происходит процесс цементации металла с контактным осаждением серебра. Поэтому электролиты на основе простых солей серебра не нашли применения в промышленности.
В свою очередь, распространение получили электролиты на основе комплексных соединений серебра. Комплексообразование позволяет сдвинуть потенциал серебра в отрицательную область, увеличить поляризацию катода, что измельчает кристаллы осадка, увеличить рассеивающую способность. Одновременно с этим комплексообразование снижает предельные плотности тока.
Первым комплексным электролитом был цианистый электролит серебрения. Он отличается наилучшими качествами получаемых покрытий, но является чрезвычайно токсичным. Поэтому одновременно с созданием цианистого электролита начались поиски электролита, не содержащего циан или, хотя бы, не содержащего его в свободном виде.
2. Механизм серебрения из цианистого электролита.
Цианистый электролит серебрения является на сегодняшний день самым изученным и самым лучшим по качеству получаемых из него осадков.
В цианистом растворе в основном образуются комплексы -ди и -три цианаргентаты: [Ag(CN)2]- и [Ag(CN)3]2- . В растворе также могут образовываться в незначительном количестве простые гидратированные ионы серебра. Таким образом основными компонентами этого электролита являются цианистый комплекс серебра, цианид щелочного металла и его карбонат, который непосредственно образуется в растворе при реакции цианида с углекислым газом воздуха.
Равновесия в цианидном растворе:
Ag+ + 2(CN)- ↔ [Ag(CN)2]-
Ag(CN) + CN- ↔ [Ag(CN)2]-
[Ag(CN)2]- + (CN)- ↔ [Ag(CN)3]2-
Ag+ + 3(CN)-↔ [Ag(CN)3]2-
Очень малое содержание свободных ионов серебра в растворе, особенно при значительных концентрациях свободного цианида, не позволяют считать, что разряд ионов серебра может идти из простых ионов по следующей схеме (теория Леблана-Шика):
[Ag(CN)2]-↔ Ag+ + 2 (CN)-
Ag+ + e = Ag0
Существует мнение, что при осаждении серебра в прикатодной области образуется коллоидный осадок AgCN по схеме:
[Ag(CN)2]-↔AgCN + (CN)-
Это подтверждается тем, что в покрытии находят цианид серебра.
М. Филгистих и др., измеряя силу тока обмена серебра в зависимости от концентрации свободного цианида пришли к выводу, что при различном содержании свободного цианида разряд ионов серебра будет идти по разным механизмам. При концентрации ионов цианида ниже 6,5 г/л может происходить разряд ионов серебра из AgCN по схеме:
[Ag(CN)3]2- = AgCN + 2(CN)-
AgCN + e = Ag + (CN)-
При концентрации цианида выше (13,5 г/л) разряд ионов серебра будет происходить по схеме:
[Ag(CN)3]2- = [Ag(CN)2]- + (CN)-
[Ag(CN)2]- + e = Ag + 2(CN)-
т.е разряд ионов серебра идет непосредственно из комплексного иона. К этому мнению приходят многие исследователи. Об этом же говорят данные потенциометрических измерений, где стационарный потенциал серебра изменяется в зависимости от содержания свободного цианида калия, причем в области низких концентраций изменяется значительно сильнее. Это еще раз подтверждает, что при большом содержании свободного цианида разряд ионов серебра идет непосредственно из комплексного иона.
Рассмотрим поляризационную кривую разряда серебра из цианидной ванны.
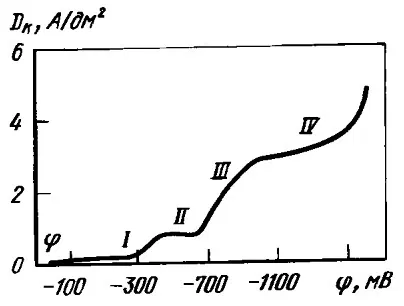
Рисунок 1 — Поляризационная кривая катодного восстановления серебра в цианидном электролите, содержащем: 40 г/л Ag (в пересчете на металл), 15 г/л свободного KCN. Температура 18-22° С
На кривой до предельного диффузионного тока можно выделить три участка, причем катодный осадок на каждом получается разным:
• Участок I. Потенциалы от -0,25 до -0,45 В. При этом емкость двойного электрического слоя имеет мала, осадки гладкие.
• Участок II. Потенциалы от -0,45 до -0,70 В. На кривой имеется перегиб, зернистость осадков повышается.
Участки I и II отвечают элементарному акту разряда, в котором участвуют анионы [Ag(CN)2]-. Перегиб при потенциале -0,45 В обусловлен малой величиной коэффициента переноса и изменением условий разряда ионов при сдвиге потенциалов в сторону более отрицательных значений, при которых возможна десорбция ионов (CN)- с поверхности электрода и ускорение разряда на этих местах ионов [Ag(CN)2]-.
• Участок III. Потенциалы выше -0,70 В. Осадки становятся шероховатыми. Выделяется водород. Могут образовываться анионы [Ag(CN)2]- по химической реакции:
[Ag(CN)3]- → [Ag(CN)2]- + (CN)-.
• Участок IV. Преимущественно выделяется водород.
3. Электролиты серебрения.
3.1 Цианистые электролиты матового серебрения.
В таблице 1 и 2 приведены составы электролитов матового цианистого серебрения.
|
Компонент электролита (г/л) и режим электролиза |
Номер электролита |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Серебро в пересчете на металл |
10 |
25 |
30-45 |
32-36 |
45-48 |
|
Калий (натрий) цианистый |
8-10 |
15-20 |
45-60 |
40-45 |
9-35 |
|
Калий (натрий) углекислый |
30 |
30 |
30-50 |
45-50 |
55-70 |
|
Калия гидроксид |
- |
- |
- |
8-15 |
- |
|
Температура |
18-20 |
18-20 |
15-20 |
40-45 |
18-20 |
|
Плотность тока А/дм2 |
0.2-0.6 |
0.2-0.6 |
0.8-1.2 |
до 10 |
2 |
|
Перемешивание (+) |
- |
- |
- с ревер-сированием тока |
+ |
- с ревер-сированием тока |
|
Электролит |
Серебро в пересчете на металл |
Калий цианистый свободный |
Калия нитрат |
Калия карбонат |
Калия гидроксид |
Температура |
Катодная плотность тока |
|
1 |
30-40 |
35-45 |
- |
- |
- |
18-25 |
0.1-0.2 |
|
2 |
20-30 |
20-40 |
- |
20-30 |
- |
18-25 |
0.3-1.5 |
|
3* |
45-60 |
70-80 |
- |
40-50 |
- |
18-25 |
2-3 |
|
4 |
25-40 |
40-60 |
70-120 |
20-50 |
- |
18-25 |
1-1.5 |
|
5 |
30-40 |
40-50 |
- |
45-50 |
8-15 |
40-50 |
<10 |
|
6** |
25-30 |
30-45 |
- |
30-50 |
- |
18-25 |
0.3-0.5 |
|
7 |
35-100 |
45-150 |
100 |
15-75 |
4-30 |
18-25 |
1-2 |
* - содержит меркаптобензотиазол 0.3-0.5 г/л
** - содержит тиосульфат натрия 0.1-0.2 г/л
3.2 Цианистые электролиты блестящего серебрения.
Составы электролитов блестящего серебрения приведены в таблице 3.
|
Компонент электролита (г/л) и режим электролиза |
Номер электролита |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
Серебро в пересчете на металл |
35-50 |
40 |
30 |
30 |
40 |
28-30 |
20-45 |
|
Калий цианистый |
100-140 |
80 |
30 |
55 |
160 |
18-20 |
60-90 |
|
Калия карбонат |
35-49 |
15 |
30 |
- |
40 |
25-30 |
- |
|
Калия гидроксид |
3-5 |
18 |
- |
- |
1 |
8-10 |
- |
|
Блескообразователь |
0.15-0.3 |
- |
- |
- |
- |
- |
- |
|
Ализариновое масло |
0.4-1.5 |
- |
- |
- |
- |
- |
- |
|
Родановый красный |
- |
0.1 |
- |
- |
- |
- |
- |
|
Натрия селенит |
- |
- |
5 |
- |
- |
- |
- |
|
Натрия тиосульфат |
- |
- |
1 |
- |
- |
- |
- |
|
Калия нитрат |
- |
- |
- |
100 |
- |
- |
- |
|
Калия селенит |
- |
- |
- |
1 |
1 |
- |
- |
|
Сурьмы трехокись |
- |
- |
- |
- |
30 |
- |
- |
|
Триэтаноламин |
- |
- |
- |
- |
5 |
- |
- |
|
Калийнатрийсурьмяновиннокислый |
- |
- |
- |
- |
5-10 |
- |
- |
|
Сегнетова соль |
- |
- |
- |
- |
40-60 |
- |
- |
|
2-3-дитиолпропан-сульфонат натрия |
- |
- |
- |
- |
- |
0.005-0.05 |
- |
|
Температура |
18-20 |
18-20 |
18-20 |
18-20 |
18-20 |
18-20 |
20-25 |
|
Плотность А/дм2 |
0.5-0.2 |
0.5 |
0.5 |
0.5-1.5 |
0.5-1.5 |
0.5-0.7 |
0.2-2.5 |
Из-за высокой профессиональной вредности цианистых электролитов, необходимости раздельной вытяжной вентиляции и нейтрализации сточных вод всегда требовалась замена цианистых элетролитов серебрения на безвредные или хотя бы менее вредные. В последние годы были разработаны и проверены в производственных условиях многие нецианистые электролиты и некоторые из них получили применение в промышленности.
В таблице 4 приведены составы наиболее распространенных нецианистых электролитов серебрения.
|
Компонент электролита (г/л) и режим электролиза |
Номер электролита |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Серебро в пересчете на металл |
25-30 |
15 |
30 |
15-20 |
20-30 |
|
Калия карбонат |
35-40 |
- |
- |
- |
- |
|
Калий железистосинеродистый |
35-40 |
- |
- |
- |
- |
|
Калий роданистый |
80-100 |
- |
- |
- |
- |
|
Калия пирофосфат |
- |
100-110 |
350-360 |
- |
- |
|
Калий йодистый |
- |
- |
- |
230-300 |
- |
|
Карбонат аммония |
- |
20-25 |
40-60 |
- |
20-30 |
|
Аммиак водный 25% |
- |
- |
- |
- |
до рН 9 |
|
Сульфосалициловая кислота |
- |
- |
- |
- |
70-90 |
|
Сульфат аммония |
- |
- |
- |
- |
45-70 |
|
рН |
- |
8.5-8.7 |
8.6-9.0 |
- |
9-9.5 |
|
Температура |
18-20 |
18-25 |
18-25 |
20-25 |
20-25 |
|
Плотность А/дм2 |
0.5-0.7 |
0.5-0.7 |
0.7-1.0 |
0.2-0.3 |
1.5 |
3.3 Пирофосфатный электролит серебрения.
Пирофосфатный электролит достаточно хорошо исследован. Его состав приведен в таблице 6.Пирофосфатный комплекс серебра получают по реакции:
AgNO3 + 2K4P2O7 = K7Ag(P2O7)2 + KNO3
В исследованиях В.В.Ореховой показано, что прочность комплекса K7Ag(P2O7)2 невысока, Кн порядка 10-7, но, несмотря на это комплекс устойчиво работает при pH 9-10 и позволяет получать плотные мелкокристаллические покрытия. Приготовление электролита осложнено плохой растворимостью пирофосфата серебра в избытке пирофосфата калия. Для лучшего растворения пирофосфата серебра небольшими порциями добавляют водный раствор аммиака и тогда раствор будет образовываться аммиачно-пирофосфатный комплекс. Пирофосфатный электролит обладает невысокой рассеивающей способностью, поэтому сложнопрофилированные детали покрывать нельзя. Прочность сцепления с бронзой и латунью хорошая, коррозионная стойкость, микротвердость, удельное и переходное сопротивление осадков из пирофосфатных и цианидных ванн примерно одинаковы. Стойкость и пирофосфатного, и смешанного комплекса невысока, поэтому изделия из меди и ее сплавов требуют предварительного серебрения. В таблице нижеприведены составы для предварительного серебрения.
|
Вид электролита |
Состав |
Содержание, г/л |
Режим осаждения |
|
Основное серебрение из пирофосфатного электролита |
Серебро (в пересчете на металл) Пирофосфат калия Карбонат аммония рН |
30 350-360 40-60 8.6-9.0 |
Температура 18-25 Катодная плотность тока 0.7 - 1.0 |
|
Предварительное серебрение из пирофосфатного электролита |
Серебро (в пересчете на металл) Пирофосфат калия Карбонат аммония рН |
15 100-110 20-25 8.5-8.7 |
Температура 18-25 Катодная плотность тока 0.5-0.7 |
|
Основное серебрение из пирофосфатно-роданистого электролита |
Нитрат серебра Пирофосфат калия Роданид калия Надсернокислый калий Производные полиглицеридаалкенилянтарной кислоты рН |
50-68 150-200 250-300 1-5 0.6-0.8 8.5-8.7 |
Перемешивание Температура 20-30 Катодная плотность тока 0.5 - 2
|
|
Предварительное серебрение из пирофосфатно-роданистого электролита |
Нитрат серебра Пирофосфат калия Роданид калия |
2.5-3 300-600 200-300 |
Загрузка под током 0.5 на 2 - 3 мин. Выдержка под током 0.1 на 2-5 минут |
К числу смешанных пирофосфатных электролитов относится пирофосфатно-роданистый электролит. Исследования показали, что выделение серебра из растворов, содержащих только пирофосфатные комплексы, происходит с незначительной поляризацией. При введении в электролит дополнительных лигандов, например, аммония или роданида, катодная поляризация заметно возрастает. Исследование структуры катодных осадков показало, что электролитические покрытия, полученные из пирофосфатно-роданистых электролитов, формируются такими же мелкозернистыми, как из цианистых электролитов. Рассеивающая способность высокая и не уступает цианистым электролитам. Выход по току - 100%.
Несмотря на вышеприведенные сведения, пирофосфатный электролит не нашел большого распространения в промышленности, так как имеет много недостатков, одним из которых является высокая стоимость и дефицитность одного из основных компонентов электролита - пирофосфата калия.
3.4 Железистосинеродистый электролит серебрения.
Отличается от смешанного электролита отсутствием роданистого калия, а количество железистосинеродистого калия увеличено до 200 г/л, но этот электролит сложен в работе, так как аноды в нем очень плохо растворяются. Практически в ванне нужно иметь наряду с растворимыми анодами также нерастворимые, но тогда этот электролит становится опасным. так как из него выделяется на аноде газообразный дициан. Состав этого электролита приведен в таблице 6.
|
Компонент |
Содержание, г/л |
Режим осаждения |
|
Хлористое серебро |
30 - 40 |
Температура: 15 - 60° С Катодная плотность тока: 0.3 - 1 А/дм2 Выход по току: 100% |
|
Железистосинеродистый калий K4Fe(CN)6 * 3H2O |
100 - 150 |
|
|
Сода кальцинированная или поташ |
30 - 60 |
|
|
Роданистый калий KCNS |
120 - 150 |
Поляризационные кривые разряда серебра в железистосинеродистом электролите приведены на рисунке 2.
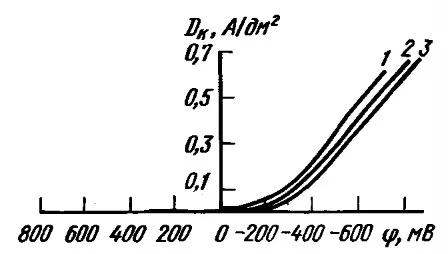
Рисунок 2 — Катодные поляризационные кривые для процесса осаждения серебра в железистосинеродистом электролите при 20° С (г/л): 1 - 15 Ag (в пересчете на металл), 40 K4Fe(CN)6, 40 K2CO3; 2 - 15 Ag (в пересчете на металл), 200 K4Fe(CN)6; 3 - 15 Ag (в пересчете на металл), 200 K4Fe(CN)6, 2 Трилон Б.
3.5 Смешанный железистосинеродисто-роданистый электролит серебрения.
Такой электролит по всем показателям не уступает цианистому и вместе с тем по профессиональной вредности несравненно безопаснее его. Его рассеивающая способность даже превышает рассеивающую способность цианистых электролитов.
Согласно источнику возможно вводить серебро в виде дицианаргентата в количестве 50-60 г/л. По этому же источнику верхние пределы вводимых компонентов увеличены примерно на 10 г/л.
Удельная электрическая проводимость электролита 0,175 Ом-1*см-1. Из электролита осаждаются светлые мелкокристаллические покрытия, обладающие высокой прочностью сцепления с основным металлом, в частности с медью и ее сплавами, без какой либо специальной обработки. Поэтому осаждение серебра можно производить без специального амальгамирования или предварительного серебрения. Применение реверсирования тока с соотношением периодов 10:1 еще больше улучшает качество покрытий.
Введение в электролит нитрат-ионов за счет составления электролита не из хлорида, а из нитрата серебра, также улучшает качество электролита, как это имеет место для цианистых электролитов.
Приготовление электролита довольно сложно - все компоненты растворяют отдельно, после чего растворы железистосинеродистого калия и поташа кипятят и приливают к соли серебра, находящейся в емкости, защищенной от света, после чего кипятят все три компонента в течение нескольких часов.
Следует отметить, что в качестве побочного продукта реакции в электролите образуется коричневый осадок гидроксида железа Fe(OH)3. Реакция разложения K4Fe(CN)6 с выделением гидроксида обычно никогда не идет до конца, вследствие чего часть непрореагировавшего осадка AgCl остается скрытой в коричневом осадке гидроксида железа. Это явление может служить причиной весьма существенных потерь серебра при составлении электролита. Поэтому осадок отфильтровывают и растворяют в химически чистой соляной кислоте. Жидкую часть, содержащую хлорида железа сливают, а осадок хлорида серебра используют вновь для приготовления электролита.
Только после этого в раствор электролит приливают требуемое количество роданистого калия, доводят электролит до заданного уровня и приступают к эксплуатации.
Уравнения протекающих реакций приведены ниже.
2AgNO3 + K4Fe(CN)6 = 2K2Ag(CN)3 + Fe(NO3)2
Fe(NO3)2 + H2O + K2CO3 = Fe(OH)2 + 2KNO3 + CO2
2Fe(OH)2 + O + H2O = 2Fe(OH)3
По некоторым данным это наиболее применимый в промышленности электролит, рекомендованный также для применения в гальванопластике.
3.6 Сульфитный электролит серебрения.
Сульфитный электролит был разработан на кафедре электрохимии Харьковского политехнического института.
Этот электролит также сложен в приготовлении. Смешивание растворов сульфита натрия и азотнокислого серебра проводят без нагрева и точно по расчету, не допуская избытка сульфита. При этом учитывается, что при длительном хранении сульфита на складе происходит выветривание кристаллизационной воды. Это увеличивает количество активного сульфита и может вызвать его избыток в растворе.
После растворения электролит готов к эксплуатации. Его режим работы приведен в таблице 7.
|
Параметр |
Значение |
|
Температура |
15 - 25° С |
|
Катодная плотность тока |
0.2 - 0.3 А/дм2 |
|
Выход по току |
100% |
Электролит обладает высокой рассеивающей способностью и позволяет получать мелкокристаллические и хорошо полируемые покрытия.
Осаждение серебра из этого электролита требует предварительного серебрения. Состав электролита и режим осаждения приведен в таблице 8.
|
Компонент |
Содержание, г/л |
Режим осаждения |
|
Хлорид серебра |
40 - 45 |
Температура 15-25° C Кат.плотность тока 0.2-0.5 |
|
Гексациано-(II) феррат калия |
60 |
|
|
Карбонат натрия |
25 |
|
|
Сульфит натрия |
100-150 |
Распространению в промышленности сульфитных электролитов мешает их нестабильность.
3.7 Йодистый электролит серебрения.
Основой электролита является комплексная соль K2AgJ3, получающаяся при растворении хлористого или сернокислого серебра в крепком растворе йодистого калия по реакции:
AgNO3 + 3KJ = K2AgJ3 + KNO3
Состав электролита и режим осаждения приведен в таблице 9.
|
Компонент |
Содержание, г/л |
Режим осаждения |
|
Хлорид серебра |
60 |
Температура 600° С Катодная плотность тока 2 А/дм2 Выход по току 100% |
|
Йодистый калий |
450 |
|
|
Желатин |
3-4 |
В электролит может добавляться сульфат натрия 1-2г/л, температура эксплуатации 18-25°С, катодная плотность тока 0.15-0.25. Электролит стабилен, но дорог.
Выход по току равен 100% при сохранении бесцветности раствора. При окрашивании раствора в желтый цвет за цвет восстановления йода выход падает до 80% . Для связывания выделяющегося на аноде йода в электролит вводят добавки сульфита натрия. При эксплуатации или хранении на складах деталей, прошедших серебрение в йодистых электролитах, имеет место пожелтение слоя серебра за счет разложения электролита, оставшегося не отмытым между кристаллами серебра. Для устранения этого дефекта детали промывают вначале в 20% растворе йодида калия, а потом уже в воде.
Для улучшения качества серебряных покрытий из йодидных электролитов предложен полиэтиленполиамин, для получения блестящих покрытий - поливиниловый спирт совместно с тиосульфатом натрия. Блеск покрытия также увеличивается при введении кислот: адипиновой, винной, глутаровой, лимонной, малеиновой, яблочной, янтарной, борной. Все указанные вещества незначительно увеличивают катодную поляризацию. Своеобразное действие на катодную поляризацию оказывает поливиниловый спирт - до предельного тока он также увеличивает поляризацию, а в области потенциалов предельного тока появляется минимум тока, который наблюдается при наличии в электролите тиосульфата натрия или кислоты совместно с ПВС.
Было установлено, что внешний вид осадков зависит от природы катиона, преобладающего в электролите. Наилучшие осадки были получены при использовании йодистого натрия. Однако предельный ток в электролите с преобладанием натрия почти вдвое ниже, чем в электролите с преобладанием калия и аммония.
Исходя из результатов исследования был предложен электролит, состав которого приведен в таблице 10.
|
Компонент |
Содержание г/л |
Режим осаждения |
|
Йодистое серебро |
20-80 |
Температура 15-25° C Катодная плотность тока 0.3-1.7 |
|
Йодистый натрий |
400-650 |
|
|
Поливиниловый спирт |
0.2-3.0 |
|
|
Тиосульфат натрия |
0.8-8.0 |
|
|
Кислота из указанного выше списка |
0.1-10 |
Несмотря на высокую стоимость йодида калия, йодистые электролиты оказались наименее агрессивными по отношению к неметаллическим основам, например к стеклу, и поэтому нашли применение в специальных процессах серебрения.
3.8 Роданистый электролит серебрения.
Отличается от смешанного электролита отсутствием железистосинеродистого калия. Поляризация в таком электролите мала.а следовательно невысока рассеивающая способность. Покрытия получаются крупнокристаллическими, но для работы с несложными изделиями этот электролит применим.стабилен в работе и позволяет вести электролиз при высоких плотностях тока. Состав и режим приведен в таблице
Составы электролитов, содержащие железистосинеродистый, роданистый калий или их смесь приведены в таблице 11.
|
Элект-ролит |
AgCl |
Agмет |
K4Fe(CN)6 *3H2O |
K2CO3 |
KSCN |
t, 0C |
iА/дм2 |
|
1*1 |
20-45 |
- |
120-200 |
15-20 |
- |
18-50 |
0.5-1.0 |
|
2 |
35-40 |
- |
200 |
20 |
- |
60-80 |
1.0-1.5 |
|
3*2 |
- |
20-25 |
40-50 |
- |
- |
18-25 |
0.15-0.25 |
|
4 |
12-15 |
- |
30 |
20 |
150 |
18-25 |
0.3-0.5 |
|
5 |
30-40 |
- |
100-150 |
30-60 |
120-150 |
18-60 |
0.3-1.0 |
|
6*3 |
- |
25 |
- |
- |
- |
18-25 |
0.5-1.0 |
|
7*4 |
- |
25-30 |
- |
- |
250-300 |
18-25 |
0.5-0.7 |
*1 Содержит трилонB 1-5 г/л, *3 Содержит, г/л, роданид аммония 300, кислота борная 20.
*2 Содержит моноэтаноламин 75-80 г/л, *4 Содержит препарат ОС-20 5-10 г/л.
3.9 Дицианоаргентатный электролит серебрения.
По данным этот электролит находит все большее распространение в промышленности. Приготовление его идет на основе дицианоаргентата калия, что снижает возвратные потери серебра практически до уровня цианидных растворов. Состав его приведен в таблице 12.
|
Компонент |
Содержание г/л |
Режим осаждения |
|
Дицианоаргентат калия |
20-40 |
Температура 18-25° C Кат.плотность тока до 1 без перемешивания до 4 с перемешиванием |
|
Роданид калия |
80-150 |
|
|
рН (доводится аммиаком) |
9-11 |
3.10 Тиосульфатный электролит серебрения.
Некоторые авторы считают, что осаждение из тиосульфатного электролита должно увеличивать коррозионную стойкость серебра, так как различные серосодержащие соединения. находящиеся в большом количестве в растворе могут, по видимому. внедряться в покрытие и образовывать соединения серы с серебром, снижая активность серебра на поверхности.
Исследовалось несколько растворов. За основу был взят раствор состава, приведенного в таблице 13.
|
Компонент |
Содержание, г/л |
Режим осаждения |
|
Нитрат серебра |
25-30° C |
Кат.плотность тока 0.1-0.7 |
|
Тиосульфат натрия пятиводный |
120 |
|
|
Сульфит натрия |
60 |
|
|
Кислота из нижеприведенного списка |
до рН 3 |
Раствор тиосульфата натрия устойчив в пределах рН = 3 - 7. При наличии большого количества кислоты происходит разложение тиосульфата и выпадение серы. Чтобы предотвратить это в раствор вводится сульфит натрия, который связывает ионы водорода и делает раствор устойчивым. Важен порядок введения компонентов: сперва смешение растворов сульфита и кислоты, затем введение соли серебра по каплям в раствор тиосульфата.и наконец смешение растворов с доведением рН кислотой до заданного значения. Для доведения рН до заданного уровня используют соляную серную и уксусную кислоту. Из такого электролита получаются матовые осадки в интервале плотностей тока 0.1-0.7 А/дм2. Однако из-за контактного обмена сцепление серебра с основой не удовлетворяет ГОСТ.
В дальнейших вариантах электролита использовались добавки роданида аммония до 30г/л для подавления контактного обмена, блескообразователей (винилпирролидон. тиоуксусная кислота.ПВП), дающие блестящие мелкокристаллические, плотные, гладкие покрытия.
Исследовано влияние концентрации компонентов раствора на катодную плотность тока. Исходя из результатов исследования, был предложен окончательный вариант электролита, состав которого приведен в таблице 14.
|
Компонент |
Содержание,г/л |
Режим осаждения |
|
Хлорид серебра |
30 |
Температура 18 - 25° C Кат.плотность тока 0.1-0.9 |
|
Тиосульфат натрия пятиводный |
100 -120 |
|
|
Сульфит натрия |
10 - 20 |
|
|
Роданид аммония |
10 - 30 |
|
|
Предельные концентрации блескообразователей: ТУК ВП ПВП |
0.1-0.2 0.4-0.6 0.2-0.4 |
|
|
рН |
3 - 7 |
3.11 Сульфосалициловый (аммиакатно-сульфосалицилатный) электролит серебрения.
|
Компонент |
Содержание,г/л |
Режим осаждения |
|
Серебро (мет) |
40-50 |
Температура 18-25° C Кат.плотность тока 0.8-1.2 |
|
Карбонат аммония |
20-30 |
|
|
Сульфат аммония |
60-80 |
|
|
Сульфосалициловая кислота |
50-100 |
В ряде работ изучалось влияние некоторых органических добавок на качество серебряных покрытий из аммиакатно-сульфосалицилатного электролита. Предложен раствор, состав которого приведен в таблице 16.
|
Компонент |
Содержание, г/л |
Режим осаждения |
|
Нитрат серебра, в пересчете на металл |
20-25 |
Температура 18-20° C Кат.плотность тока 0.8-2.0 Sa:Sk = 2 : 1 |
|
Сульфосалициловая кислота |
110-120 |
|
|
Карбонат аммония |
20-30 |
|
|
рН (доводится 25%NH4OH) |
9.0-9.2 |
В работе были исследованы представители различных классов органических соединений, из которых большое внимание было уделено серосодержащим добавкам и аминосоединениям, представители которых играют роль блескообразователей в цианистых электролитах. По предварительным исследованиям наибольший практический интерес представили добавки, относящиеся к классу гетероциклических аминов (условное название добавки- ЛТИ - 2). Однако одной добавки оказалось недостаточно, так как на поверхности деталей появлялся "питтинг", что устранялось введением вторичной добавки из класса гликолей (этиленгликоль или диэтиленгликоль).
С увеличением концентрации добавки с 10 до 20 г/л степень блеска возрастает с 60 до 97-98%. С повышением концентрации до 30 г/л раствор перестает быть стабильным. Введение добавки также увеличивает микротвердость покрытия. Введение блескообразователя незначительно увеличивает удельное сопротивление покрытия, а введение гликолей, напротив, оказывает значительное влияние и увеличивает сопротивление в 2 раза, по сравнению с матовым покрытием. На основании данного исследования авторы рекомендуют использование электролита с концентрацией блескообразователя 15 - 20 г/л и смачивателя ЭГ - 1-2 мл/л
Состав сульфосалицилатного электролита приводится в таблица 17. Результаты исследования по выбору смачивателя находятся в таблице 18.
|
Компоненты электролита |
Номер электролита |
||
|
1 |
2 |
3 |
|
|
Нитрат серебра (в пересчете на металл) |
30 |
30 |
30 |
|
Сульфосалициловая кислота |
110 |
110 |
110 |
|
Карбонат аммония |
20 |
20 |
20 |
|
Пиперазин |
20 |
20 |
20 |
|
Этиленгликоль |
- |
1 |
- |
|
Диэтиленгликоль |
- |
- |
10 |
|
Примечание. Перемешивание - механическое, рН электролита 9.0-9.2, плотность тока 1.5 А/дм2, температура электролита 20° C |
|||
|
Смачиватель |
Концентрация г/л |
Плотность тока А/дм2 |
Внешний вид осадка |
|
Препарат ОС-20 |
0.5 1.0 1.0 |
1.5 1.0 1.2 |
Полублестящий |
|
Этиленгликоль |
1.0 1.0 1.0 10.0 20.0 20.0 |
1.5 1.0 1.2 1.0 1.7 1.5 |
Блестящий |
|
Диэтиленгликоль |
0.5 0.5 1.0 1.0 10.0 |
1.5 1.5 1.0 1.5 1.5 |
|
|
Триэтиленгликоль |
1.0 1.0 10.0 |
1.0 1.5 1.5 |
3.12 Трилонатный электролит.
Трилонатный электролит упоминается для получения серебряных покрытий под пайку. Покрытия, полученные из этого раствора на медных пластинах одинаково хорошо паяются как непосредственно перед электроосаждением, так и после месячной выдержки.
|
Компонент |
Содержание моль/л |
Режим осаждения |
|
Нитрат серебра |
0.3-0.4 |
Температура 18-25° C Кат.плотность тока 0.3-0.8 без перемешивания до 1.4 с перемешиванием. |
|
Трилон Б (ЭДТА) |
0.3-0.6 |
|
|
Гидроксид натрия |
0.6-1.2 |
|
|
Ацетат, сульфат или нитрат аммония |
0.4-0.5 |
|
|
Аммиак |
до pH 9.5 - 10.5 |
При приготовлении электролита в раствор трилона Б вводят раствор гидроксида натрия до рН=10 и затем азотнокислое серебро и аммонийную соль. Электролит корректируется 25% раствором аммиака до рН=10.
3.13 Аммиачный электролит серебрения.
|
Компонент |
Содержание |
Режим осаждения |
|
Нитрат серебра |
45-65 г/л |
Температура 18-25° C Кат. плотность тока 0,8-1.5 А/дм2
|
|
Аммиак водный 25% |
90-110 мл/л |
|
|
Сульфат аммония |
200-250 г/л |
|
|
рН |
6,7-7,4 |
Отмечается его меньшая стабильность, по сравнению с цианистым раствором.
3.14 Метансульфонатно-сукцинимидные электролиты серебрения.
Исследование поведения серебра в щелочных (рН=10-11) растворах показало, что серебро образует с сукцинимидомкомплексы типа Ag(C4H5NO2)2 2- .
Из электролитов, приготовленных из метансульфоната серебра и сукцинимида в присутствии блескообразующей добавки, полиэтиленимина 0.1-0.5 г/л, при рН-9-10, комнатной температуре и плотности тока 1-3 А/дм2 получаются зеркально-блестящие покрытия с голубоватым отливом на деталях из меди, никеля медных и никелевых сплавов. Однако, данный электролит не достаточно устойчив во времени. В течение 7-10 дней он медленно разлагается с образованием мелкодисперсного серебросодержащего коллоидного осадка, в объеме электролита, при этом ухудшается качество нанесенных покрытий. Причина неустойчивости электролита может быть связана со снижением рН до 7 за счет взаимодействия гидроксида натрия, входящего в состав электролита, с углекислым газом атмосферного воздуха.
Изучение анодной поляризации показало, что серебро растворяется на аноде с выходом по току менее 60%, а катодный выход по току более 90%, это требует корректировки состава электролита по серебру в процессе электролиза. Золото практически нерастворимо в сукцинимидных электролитах, анодный выход по току менее 10%, при катодном выходе по току более 80%.
3.15 Нитратный электролит серебрения.
Нитратный электролит был разработан в Киевском политехническом институте.
|
Компонент |
Содержание г/л |
Режим осаждения |
|
Нитрат серебра |
30-200 |
Температура 18-25° C Кат.плотность тока 0.5-3.0 |
|
Азотная кислота |
20-40 |
|
|
Метионин или тиразин |
0.2-0.6 |
Электролит имеет низкую рассеивающую способность, но может применяться как скоростной.
В чем особенности электролитов блестящего серебрения?
Как уже упоминалось ранее, обычно из электролитов серебрения получаются матовые осадки. Последующая полировка вызывают увеличение расходов, связанных с потерями серебра и с самим полированием. Избавиться от этих потерь можно использованием блескообразователей. В этой части обзора будет обобщена информация о блескообразователях. Механизм образования блестящих покрытий сложен и еще до сих пор не существует единой теории их получения.
Так как цианистые электролиты были наиболее распространены на практике, большое число блескообразователей известно именно для них. Их подразделяют на:
- Сероуглерод и его производные;
- Неорганические соединения серы;
- Органические соединения серы;
- Соединения селена и теллура;
- Металлы IVи V групп периодической системы элементов Д.И. Менделеева.
Сероуглерод в качестве блескообразователя известен давно, но из-за его сильной ядовитости практически не применяется в чистом виде. На практике применяются его более устойчивые и менее токсичные производные. Такими являются соли ксантогенатовой кислоты. Щелочные ксантогенаты образуются действием этилового спирта на сероуглерод в присутствии щелочи.
Также для цианистых электролитах применяют ализариновое масло, которое является продуктом обработки касторового масла серной кислой.
Существует группа блескообразователей, представляющих собой продукт конденсации сероуглерода с кетонами, альдегидами или другими органическими соединениями с двойной или тройной ненасыщенными связями. Эти продукты легко растворимы в щелочных растворах.
К неорганическим соединениям серы в качестве блескообразователей можно отнести тиосульфат натрия, однако применение его приводит к получению только полублестящих покрытий. Добавка формальдегидсульфоксилата натрия и сульфированного продукта конденсации жирных кислот повышает блескообразующий эффект тиосульфата.
Иногда в качестве блескообразователя применяют роданиды или их соединения, например родановый красный. В качестве органических блескообразователей применяют некоторые органические соединения серы (типа меркаптана): меркаптобензотиазол или гетероциклические соединения меркаптана. Соединения селена и теллура улучшают свое действие при введении соединий серы. В качестве таких блескообразователей применяют селениды, селениты или KCNSe.
Соединения элементов 4 и 5 группы периодической системы тоже могут быть хорошими блескообразователями, особенно соединения сурьмы и висмута.
Сурьма вводится в виде сурьмяновиннокислого калия.
В качестве блескообразователей также применяются оксикислоты, аминокислоты, оксиспирты, некоторые ароматические соединения.
Получение блестящих покрытий серебром из нецианистых электролитов менее исследовано.
В чем достоинства и недостатки различных электролитов серебрения?
Исходя из литературных данных можно привести значения констант нестойкости для комплексов серебра в различных электролитах серебрения.
|
Электролит |
Комплекс |
Значение константы нестойкости |
|
Цианистый |
[Ag(CN)2]- [Ag(CN)3]2- |
8*10-22 1,6 *10-22 |
|
Железистосинеродистый |
[Ag(CN)3]2- |
1,6 *10-22 |
|
Роданистый |
Ag(CNS)2- |
2,7*10-8 |
|
Пирофосфатный |
K7Ag(P2O7)2 |
10-7 |
|
Йодатный |
K2AgJ3 |
1,4*10-11 |
|
Дицианаргентатный |
[Ag(CN)2]- |
8*10-22 |
|
Трилонатный |
AgЭДТА3- |
4,8*10-8 |
|
Электролит |
Достоинства |
Недостатки |
|
Цианистый |
Наилучшее качество осадков |
Токсичность Неустойчивость |
|
Железистосинеродисто-роданистый |
Качество осадков близко к качеству осадков из цианистого электролита |
Ухудшение качества осадков за счет постепенного разряда не из синеродистого, а из роданистого комплекса |
|
Железистосинеродистый |
|
Плохо растворимые аноды |
|
Роданистый |
Пригоден для работы с несложными изделиями, стабилен и позволяет вести электролиз при высоких плотностях тока |
Поляризация мала, невысокая рассеивающая способность |
|
Пирофосфатный |
Мелкокристаллические осадки, высокая рассеивающая способность, 100% Вт |
Низкая рассеивающая способность |
|
Йодистый |
Наименее агрессивным по отношению к неметаллическим основам, нашел применение в специальных процессах серебрения |
Желтизна осадка Высокая стоимость йодистого калия |
|
Сульфосалицилатный |
|
Электролит быстро окисляется При наличии в растворе аммиака - выделение аммиака. |
|
Дицианаргентатный |
Хорошее качество осадков |
Накопление свободного цианида |
|
Тиосульфатный |
|
Неустойчив - выпадает сера На катоде может выделяться сероводород |
|
Метансульфонатно - сукцинамидный |
Нетоксичен |
Неустойчивость, неравномерный катодный и анодный выход по току |
Подробно анодные процессы при серебрении рассмотрены здесь
Читайте также статьи
Механизм оловянирования (лужения)
Что такое олово и висмут? Механизм оловянирования и структура покрытия
Гальванические покрытия в электротехнике
Токоведущие шины. Для чего используются и какие характеристики имеют?
Токопроводящие кристаллы (усы) на оловянном покрытии
Природа оловянных усов и механизм их образования

Хотите стать нашим клиентом?
Просто оставьте Вашу заявку, заполнив форму справа и мы свяжемся с Вами в ближайшее время. Спасибо!

Отправляя заявку, Вы даете согласие на обработку Ваших персональных данных. Ваши данные под защитой.



